题目内容
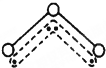
关于如图所示装置的叙述中正确的是( )
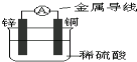

| A、当有0.2mol电子通过电路,产生H2体积为2.24L |
| B、电子从锌片经金属导线流向铜片 |
| C、铜片质量逐渐减少 |
| D、溶液中的氢离子向锌电极移动 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该装置中,锌易失电子作负极,铜作正极,负极上失电子发生氧化反应,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极,根据正极的电极反应式结合电子守恒计算生成的氢气的体积.
解答:
解:A.铜为正极,正极氢离子得电子发生还原反应,电极反应为2H++2e-=H2↑,则当有0.2mol电子通过电路,产生H2体积在标准状况下为2.24L,题目中没有说明是标准状况,故A错误;
B.电子从负极流向正极,即电子从Zn片经导线流向Cu片,故B正确;
C.Cu电极上氢离子得电子生成氢气,Cu不参加反应,铜的质量不变,故C错误;
D.溶液中阳离子向正极移动,即氢离子向铜电极移动,故D错误.
故选B.
B.电子从负极流向正极,即电子从Zn片经导线流向Cu片,故B正确;
C.Cu电极上氢离子得电子生成氢气,Cu不参加反应,铜的质量不变,故C错误;
D.溶液中阳离子向正极移动,即氢离子向铜电极移动,故D错误.
故选B.
点评:本题考查了原电池工作原理,要会根据正负极上得失电子判断发生反应的反应类型、现象及电子流向等知识点,会写电极反应式,题目难度不大.

练习册系列答案
相关题目
将20mL 0.5mol?L-1盐酸与一块状大理石反应,下列的措施不能提高化学反应速率的是( )
| A、加入10mL 3mol?L-1盐酸 |
| B、给反应混合物加热 |
| C、将所用的大理石研磨成粉末 |
| D、加入10mL蒸馏水 |
以下四种有机物的分子式皆为C4H10O:
①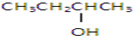
②CH3CH2CH2CH2OH
③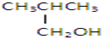
④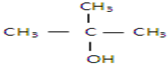
其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
①
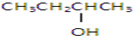
②CH3CH2CH2CH2OH
③
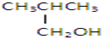
④
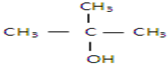
其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
| A、①② | B、只有② |
| C、②和③ | D、③和④ |
下列叙述中,正确的是( )
| A、12g碳所含的原子数就是阿伏加德罗常数 |
| B、阿伏加德罗常数没有单位 |
| C、“物质的量”指物质的质量 |
| D、摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒 |
合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g)△H=-92.4kJ?mol-1.现将1molN2(g)、3molH2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分为?,下列说法中正确的是
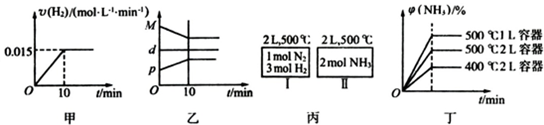 ( )
( )
 ( )
( )| A、若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 |
| B、反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 |
| C、如图丙所示,容器I和II达到平衡时所需要的时间可能不同 |
| D、若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
 臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )
臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )| A、SO2 |
| B、C3H6 |
| C、CO2 |
| D、CNO- |
已知某温度、压强下,2molH2的体积是22.4L,下列有关说法中正确的是( )
| A、该条件下,气体的摩尔体积是22.4L?mol-1 |
| B、该条件下,32gO2的体积是22.4L |
| C、该条件下,1molN2的体积是11.2L |
| D、该条件下,9.03×1023个H2O分子的体积是16.8L |
下列反应中,不能用2H++CO32-=H2O+CO2↑表示的反应是( )
| A、2HCl+Na2CO3=H2O+CO2↑+2NaCl |
| B、NaHCO3+HCl=NaCl+CO2↑+H2O |
| C、H2SO4+K2CO3=H2O+CO2↑+2KCl |
| D、2HNO3+K2CO3=H2O+CO2↑+2KNO3 |
下列有关化学反应速率的描述中正确的是( )
| A、在任何化学反应中,只要提高反应温度,就可提高反应速率 |
| B、在任何化学反应中,只要增大某一反应物的用量,就会增大反应速率 |
| C、在任何化学反应中,增大压强时,都会使反应速率增大 |
| D、在任何化学反应中,只要缩小容器的体积,都会使反应速率增大 |