题目内容
H2O与H2S结构相似,都是V型的极性分子,但是H2O的沸点是100℃,H2S的沸点是-60.7℃.引起这种差异的主要原因是( )
| A、范德华力 | B、共价键 |
| C、氢键 | D、相对分子质量 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:H2O,HF,NH3中因为含有氢键,所以其沸点高于同族其他元素的氢化物.
解答:
解:H2O与H2S都属于分子晶体,H2O分子间可以形成氢键,H2S只含有范德华力,所以水的沸点高于H2S的沸点,
故选C.
故选C.
点评:本题考查了氢键对物质熔沸点的影响,题目难度不大,氢键为高考中的高频考点,H2O,HF,NH3中因为含有氢键,所以其沸点高于同族其他元素的氢化物.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
我国探月的目的之一是探测月球土壤厚度和
He的储量.
He是最安全最清洁的能源,地球上仅有15t左右,而月球上的
He估计在1.0×106~1.5×106t.地球上氦元素主要以
He的形式存在.已知一个12C原子的质量为a g,一个
He原子的质量为b g,NA为阿伏加德罗常数.下列说法正确的是( )
3 2 |
3 2 |
3 2 |
4 2 |
3 2 |
A、
| ||||
| B、氦元素的近似相对原子质量为3 | ||||
C、
| ||||
D、
|
下列的晶体中,化学键种类相同、晶体类型也相同的是( )
| A、SO3与SiO2 |
| B、NO2与H2O |
| C、NaCl与HCl |
| D、CCl4与KCl |
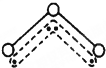 臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )
臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )| A、SO2 |
| B、C3H6 |
| C、CO2 |
| D、CNO- |
下列化学用语不正确的是:( )
| A、乙烯的结构简式:CH2=CH2 |
B、二氧化硫分子比例模型: |
| C、漂粉精的主要成分:CaCl2 |
| D、HCN分子的结构式:H-C≡N |
下列实验装置图正确的是( )
A、 实验室制备并检验乙烯 |
B、 石油分馏 |
C、 验证醋酸、碳酸、苯酚酸性强弱 |
D、 实验室制乙炔 |
1g N2所占有的体积为V L,则N2的摩尔体积为( )
| A、28V L/mol |
| B、22.4 L/mol |
| C、(28/V) L/mol |
| D、(V/28)L/mol |
关于配合物[Zn(NH3)4]Cl2的说法正确的是( )
| A、配位数为6 |
| B、配体为NH3和Cl- |
| C、[Zn(NH3)4]2+为内界 |
| D、Zn2+和NH3以离子键结合 |



