题目内容
下列有关硝酸的说法中正确的是( )
| A、冷的浓硝酸不与铝反应 |
| B、硝酸具有强氧化性和不稳定性 |
| C、硝酸通常略显黄色,是因为在其中溶解了Fe3+的缘故 |
| D、稀硝酸与铁反应生成H2和Fe(NO3)2 |
考点:硝酸的化学性质
专题:元素及其化合物
分析:A.冷的浓硝酸和铝发生钝化现象;
B.硝酸具有强氧化性和不稳定性,能氧化Cu等不活泼金属;
C.浓硝酸不稳定,易分解;
D.稀硝酸和铁反应生成硝酸盐和氮氧化物.
B.硝酸具有强氧化性和不稳定性,能氧化Cu等不活泼金属;
C.浓硝酸不稳定,易分解;
D.稀硝酸和铁反应生成硝酸盐和氮氧化物.
解答:
解:A.冷的浓硝酸和铝发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,故A错误;
B.硝酸具有强氧化性,能氧化Cu等不活泼金属,且不稳定,易分解,故B正确;
C.浓硝酸不稳定,易分解,反应方程式为4HNO3
4NO2↑+O2↑+2H2O,生成的二氧化氮溶于硝酸而使溶液呈黄色,故C错误;
D.硝酸具有强氧化性,能和金属反应生成氮氧化物而不是氢气,故D错误;
故选B.
B.硝酸具有强氧化性,能氧化Cu等不活泼金属,且不稳定,易分解,故B正确;
C.浓硝酸不稳定,易分解,反应方程式为4HNO3
| ||
D.硝酸具有强氧化性,能和金属反应生成氮氧化物而不是氢气,故D错误;
故选B.
点评:本题考查了硝酸的性质,硝酸具有强氧化性、挥发性、不稳定性,知道硝酸和盐酸呈黄色的区别,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
根据下列实验现象所得出的结论中,一定正确的是( )
| A、无色溶液焰色反应呈黄色.结论:该试液是钠盐溶液 |
| B、无色溶液中加入BaCl2溶液产生不溶于酸的白色沉淀.结论:该溶液中含SO42- |
| C、无色溶液中加入Na2CO3溶液,产生白色沉淀.结论:该试液是Ca(OH)2溶液 |
| D、无色溶液能使红色石蕊试纸变蓝色.结论:该溶液显碱性 |
用固体氯化钠配制浓度为1.00mol/L的氯化钠溶液100mL,用不到的仪器是( )
| A、托盘天平 | B、容量瓶 |
| C、玻璃棒 | D、试管 |
下列反应的离子方程式书写正确的是( )
| A、电解饱和食盐水:2Cl-+2H+=H2↑+Cl2↑ |
| B、浓盐酸与二氧化锰反应制氯气:MnO2+2Cl-+2H+=Cl2↑+Mn2++H2O |
| C、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| D、向溴化亚铁溶液中通入过量的氯气:2Fe2++Cl2=2Cl-+2Fe3+ |
以下四种有机物的分子式皆为C4H10O:
①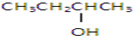
②CH3CH2CH2CH2OH
③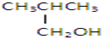
④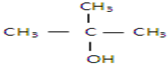
其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
①
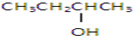
②CH3CH2CH2CH2OH
③
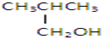
④
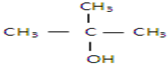
其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
| A、①② | B、只有② |
| C、②和③ | D、③和④ |
下列叙述中,正确的是( )
| A、12g碳所含的原子数就是阿伏加德罗常数 |
| B、阿伏加德罗常数没有单位 |
| C、“物质的量”指物质的质量 |
| D、摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒 |
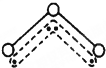 臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )
臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )| A、SO2 |
| B、C3H6 |
| C、CO2 |
| D、CNO- |
工业上生产镁粉是将电解生成的镁蒸气在下列某气体中冷却而获得的,该气体是( )
| A、空气 | B、氮气 |
| C、氢气 | D、二氧化碳 |



