题目内容
下列物质:①BeCl2②SiC③白磷④BF3⑤NH3⑥过氧化氢其中含极性键的非极性分子是( )
| A、①③④ | B、②③⑥ |
| C、①④ | D、①③④⑤ |
考点:极性分子和非极性分子,极性键和非极性键
专题:化学键与晶体结构
分析:由不同非金属元素形成的化学键为极性键,由同种非金属元素形成的化学键为非极性键,只含非极性键的分子为非极性分子;若分子含有极性键,但结构对称,正负电荷的中心重合,则为非极性分子,极性分子中正负电荷的中心不重合,具有一定的极性,以此来解答.
解答:
解:①BeCl2中含有极性键,为直线形分子,结构对称正负电荷重心重叠,为非极性分子,故正确;
②SiC属于原子晶体,晶体中不存在分子,故错误,
③白磷为单质,分子中只含有非极性键,属于非极性分子,故错误;
④BF3中含有极性键,为平面三角形分子,正负电荷重心重叠,为非极性分子,故正确;
⑤NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,为极性分子,故错误;
⑥过氧化氢中含有极性键,但氧含有孤对电子,过氧化氢结构不对称,属于极性分子,故错误;
故选C.
②SiC属于原子晶体,晶体中不存在分子,故错误,
③白磷为单质,分子中只含有非极性键,属于非极性分子,故错误;
④BF3中含有极性键,为平面三角形分子,正负电荷重心重叠,为非极性分子,故正确;
⑤NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,为极性分子,故错误;
⑥过氧化氢中含有极性键,但氧含有孤对电子,过氧化氢结构不对称,属于极性分子,故错误;
故选C.
点评:本题考查极性键和非极性键,熟悉常见元素之间的成键是解答本题的关键,注意化学键、空间构型与分子的极性的关系来分析解答即可,难度不大.

练习册系列答案
相关题目
 臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )
臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )| A、SO2 |
| B、C3H6 |
| C、CO2 |
| D、CNO- |
工业上生产镁粉是将电解生成的镁蒸气在下列某气体中冷却而获得的,该气体是( )
| A、空气 | B、氮气 |
| C、氢气 | D、二氧化碳 |
在下列饱和溶液中通入CO2不会出现沉淀现象的是( )
| A、CaCl2 |
| B、NaAlO2 |
| C、Na2CO3 |
| D、Ba(OH)2 |
下列有关化学反应速率的描述中正确的是( )
| A、在任何化学反应中,只要提高反应温度,就可提高反应速率 |
| B、在任何化学反应中,只要增大某一反应物的用量,就会增大反应速率 |
| C、在任何化学反应中,增大压强时,都会使反应速率增大 |
| D、在任何化学反应中,只要缩小容器的体积,都会使反应速率增大 |
关于配合物[Zn(NH3)4]Cl2的说法正确的是( )
| A、配位数为6 |
| B、配体为NH3和Cl- |
| C、[Zn(NH3)4]2+为内界 |
| D、Zn2+和NH3以离子键结合 |
下列实验中用错试剂的是( )
| A、用稀硝酸洗去残留在试管壁上的铜 |
| B、用浓硫酸吸收氨气中的水蒸气 |
| C、用稀盐酸清洗做焰色反应的铂丝 |
| D、用浓硫酸吸收氯气中的水蒸气 |
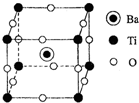 钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.
钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.