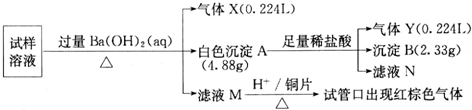
题目内容
垃圾是放错地方的资源,工业废料也可以再利用.某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3).其实验方案如下:
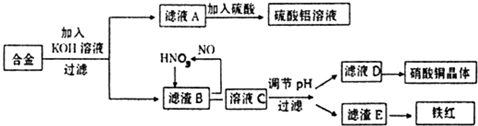
(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式: 写出滤渣B中发生反应的离子方程式:
(2)已知Fe(OH)3沉淀的pH是2~3.2,溶液C通过调节pH可以使Fe3+沉淀完全.下列物质中,可用作调整溶液C的pH的试剂是 (填序号)
A.铜粉 B.氨水 C.氧化铜 D.氢氧化铜
(3)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、 (填操作名称)、自然干燥.
(4)选用提供的试剂,设计实验验证铁红中是否含有FeO.
提供的试剂:a.稀盐酸 b.稀硫酸 c.KSCN溶液 d.KMnO4溶液 e.NaOH溶液 f.碘水
所选用的试剂为 (填序号);证明铁红中含有FeO的实验现象为 .
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol?L-1,c(H2SO4)=3mol?L-1,将0.3mol的铜放入并充分反应后,被还原的HNO3的物质的量为 .

(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:
(2)已知Fe(OH)3沉淀的pH是2~3.2,溶液C通过调节pH可以使Fe3+沉淀完全.下列物质中,可用作调整溶液C的pH的试剂是
A.铜粉 B.氨水 C.氧化铜 D.氢氧化铜
(3)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、
(4)选用提供的试剂,设计实验验证铁红中是否含有FeO.
提供的试剂:a.稀盐酸 b.稀硫酸 c.KSCN溶液 d.KMnO4溶液 e.NaOH溶液 f.碘水
所选用的试剂为
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol?L-1,c(H2SO4)=3mol?L-1,将0.3mol的铜放入并充分反应后,被还原的HNO3的物质的量为
考点:金属的回收与环境、资源保护,物质的分离、提纯和除杂
专题:实验题
分析:(1)只有铝具有两性,故能与KOH反应,所以滤液为偏铝酸钾,加入硫酸后,生成铝离子;
(2)升高pH值,即降低酸性,不能引入新的杂质,据此分析解答即可;
(3)从液体中获取固体的方法,常用加热浓缩、冷却结晶、过滤的方法,据此解答即可;
(4)酸性高锰酸钾具有氧化性,据此解答即可;
(5)依据离子反应方程式回答即可.
(2)升高pH值,即降低酸性,不能引入新的杂质,据此分析解答即可;
(3)从液体中获取固体的方法,常用加热浓缩、冷却结晶、过滤的方法,据此解答即可;
(4)酸性高锰酸钾具有氧化性,据此解答即可;
(5)依据离子反应方程式回答即可.
解答:
解:(1)铝和氢氧化钾反应生成偏铝酸钾,偏铝酸钾和硫酸反应生成硫酸铝和水AlO2-+4H+=Al3++2H2O;
铜和铁与稀硝酸能发生反应生成硝酸盐和一氧化氮、水,3Cu+8H++2NO3=3Cu2++2NO↑+4H2O;4H++NO-3+Fe=Fe3++NO↑+2H2O,故答案为:AlO2-+4H+=Al3++2H2O,3Cu+8H++2NO3=3Cu2++2NO↑+4H2O;4H++NO-3+Fe=Fe3++NO↑+2H2O;
(2)能调节溶液的PH值且不引进新的杂质,故选CD;
(3)分离固体和液体采用过滤方法,故答案为:过滤;
(4)先用稀硫酸溶解使氧化亚铁转化为二价铁离子,再用酸性高锰酸钾溶液检验二价铁离子是否存在,故选bd;FeO具有还原性,高锰酸钾具有氧化性,故稀硫酸溶解铁红所得溶液使KMnO4溶液褪色,故答案为:bd;稀硫酸溶解铁红所得溶液使KMnO4溶液褪色.
(5)硝酸的物质的量是0.1L×2mol/L=0.2mol,硫酸的物质的量是0.1L×3mol/L=0.3mol,铜和硝酸反应时,硫酸中的氢离子能补充,使其作硝酸使用,依据离子反应方程式:3Cu+8H++2NO3=3Cu2++2NO↑+4H2O
3 8 2
0.3mol x,
解x=0.2mol,所以被还原的硝酸的物质的量是0.2mol,故答案为:0.2mol.
铜和铁与稀硝酸能发生反应生成硝酸盐和一氧化氮、水,3Cu+8H++2NO3=3Cu2++2NO↑+4H2O;4H++NO-3+Fe=Fe3++NO↑+2H2O,故答案为:AlO2-+4H+=Al3++2H2O,3Cu+8H++2NO3=3Cu2++2NO↑+4H2O;4H++NO-3+Fe=Fe3++NO↑+2H2O;
(2)能调节溶液的PH值且不引进新的杂质,故选CD;
(3)分离固体和液体采用过滤方法,故答案为:过滤;
(4)先用稀硫酸溶解使氧化亚铁转化为二价铁离子,再用酸性高锰酸钾溶液检验二价铁离子是否存在,故选bd;FeO具有还原性,高锰酸钾具有氧化性,故稀硫酸溶解铁红所得溶液使KMnO4溶液褪色,故答案为:bd;稀硫酸溶解铁红所得溶液使KMnO4溶液褪色.
(5)硝酸的物质的量是0.1L×2mol/L=0.2mol,硫酸的物质的量是0.1L×3mol/L=0.3mol,铜和硝酸反应时,硫酸中的氢离子能补充,使其作硝酸使用,依据离子反应方程式:3Cu+8H++2NO3=3Cu2++2NO↑+4H2O
3 8 2
0.3mol x,
解x=0.2mol,所以被还原的硝酸的物质的量是0.2mol,故答案为:0.2mol.
点评:本题主要考查的是离子反应方程式的书写,常见物质的检验、氧化还原反应等,综合性较强,但是难度不大.

练习册系列答案
相关题目
下列说法中,正确的是( )
| A、饱和Ca(OH)2溶液中加入一定量的生石灰,恢复至原来的温度,得溶液的pH值会增大 |
| B、等体积、等pH的NH4Cl溶液和盐酸,完全溶解少量且等同的镁粉,前者反应快 |
| C、将nmol H2(g)、n mol I2(g)和2n mol H2(g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D、某物质的溶液中由水电离出的c(H+)=1×10-amol.L-1,若α>7时,则该溶液的pH一定为14-α |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的内层电子总数是最外层电子数的5倍.下列说法中不正确的是( )
| A、W、M的某种单质可作为水处理中的消毒剂 |
| B、电解YW2的熔融物可制得Y和W的单质 |
| C、相同条件下,W的氢化物水溶液酸性比Z弱 |
| D、X、M两种元素形成的一种化合物与水反应可生成M的某种单质 |
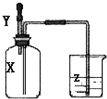 如图所示,集气瓶内充满某气体X,将滴管内的溶液Y挤入集气瓶后,烧杯中的溶液Z会进入集气瓶,然后又会有溶液被压回烧杯,则下列组合正确的是( )
如图所示,集气瓶内充满某气体X,将滴管内的溶液Y挤入集气瓶后,烧杯中的溶液Z会进入集气瓶,然后又会有溶液被压回烧杯,则下列组合正确的是( )