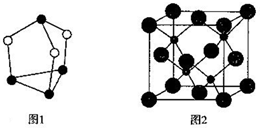
题目内容
4.利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
(1)“水解”时生成气体M,M的化学式为NH3.
(2)“氧化”时,被氧化的离子是Fe2+.
(3)“酸溶”时,Al2O3发生反应的离子方程式为Al2O3+6H+=2Al3++3H2O.
(4)采用喷雾干燥而不用蒸发的原因是防止Al(OH)2Cl水解生成Al(OH)3.
(5)用铝和金属氧化物反应制备金属单质是工业上较常用的方法,如2Al+4BaO$\frac{\underline{\;高温\;}}{\;}$3Ba↑+BaO•Al2O3.常温下Al的金属性比Ba的金属性弱(填“强”或“弱”).利用上述方法可制取Ba的主要原因是d.
a.高温时Al的金属活动性大于Ba b.高温有利于BaO分解
c.高温时BaO•Al2O3比Al2O3稳定 d.Ba的沸点比Al的低.
分析 铝灰主要成分为Al、Al2O3、AlN、FeO等,加水发生反应,AlN发生水解生成氢氧化铝和氨气,加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,加入漂白剂氧化亚铁离子为铁离子,加入纯碱调节溶液pH使铁离子转化为氢氧化铁沉淀,采用喷雾干燥制备铝鞣剂,
(1)AlN水解得到气体M是氨气,加热可以促进氮化铝水解生成氨气,有利于氨气的逸出;
(2)加入NaClO的作用是利用次氯酸根离子在酸溶液中的强氧化性,将氧化亚铁离子为铁离子;
(3)酸溶时使用的酸是盐酸,氧化铝溶于酸生成氯化铝溶液;
(4)铝鞣剂主要成分为Al(OH)2Cl,在加热蒸发时会发生水解,为防止水解利用喷雾干燥,减少铝鞣剂水解;
(5)常温下Al的金属性比Ba的金属性弱,该反应是利用Ba的沸点比Al的低.
解答 解:铝灰主要成分为Al、Al2O3、AlN、FeO等,加水发生反应,AlN发生水解生成氢氧化铝和氨气,加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,加入NaClO氧化亚铁离子为铁离子,加入纯碱调节溶液pH使铁离子转化为氢氧化铁沉淀,采用喷雾干燥制备铝鞣剂.
(1)AlN水解得到气体M是NH3,加热可以加快AlN水解反应速率,降低NH3在水中的溶解度,促使NH3逸出,
故答案为:NH3;
(2)加入NaClO的作用是利用次氯酸根离子在酸溶液中的强氧化性,将氧化亚铁离子为铁离子,反应离子方程式为:2Fe2++2H++ClO-═2Fe3++Cl-+H2O,
故答案为:Fe2+;
(3)由流程图可知,酸溶时使用的酸是盐酸,氧化铝溶解生成氯化铝溶液,反应的离子方程式:Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;
(4)铝鞣剂主要成分为Al(OH)2Cl,在加热蒸发时会发生水解,为防止水解利用喷雾干燥,减少铝鞣剂水解,
故答案为:防止Al(OH)2Cl水解生成Al(OH)3;
(5)利用元素Ba、Al在元素周期表的位置可知金属活泼性:Al<Ba;但Al在高温下可将氧化钡中钡置换出来,原因是Ba的沸点低于铝,高温时Ba转化为气体脱离反应体系,使反应正向进行,
故答案为:弱;d.
点评 本题考查物质准备工艺流程,涉及对操作的分析评价、对条件控制分析、物质含量测定等,熟练掌握元素化合物知识,树立资源回收再利用意识,是对学生综合能力的考查.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| A. | NaOH溶液不能用带磨口玻璃塞的玻璃瓶盛放 | |
| B. | CO2与水反应生成碳酸,是酸性氧化物;SiO2不能与水反应生成硅酸,不是酸性氧化物 | |
| C. | 除去二氧化硅中少量的碳酸钙杂质应选用水 | |
| D. | 粗硅制备时,发生的反应为C+SiO2═Si+CO2↑ |
| A. | 石油里含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含有C18以上的烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 石油的分馏是一个物理过程,而裂化及裂解属于化学过程 | |
| D. | 石油裂解的惟一目的是获得乙烯 |
| A. | 具有氧化性 | B. | 具有还原性 | C. | 具有漂白性 | D. | 含有极性键 |

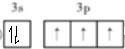 ,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).
,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).