题目内容
1.春秋末期齐国的工艺官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰)和“蜃”(贝壳灰)混合加水所得液体来洗涤丝帛.这种液体能洗涤丝帛主要是因为其中含有( )| A. | 氧化钙 | B. | 碳酸钠 | C. | 氢氧化钾 | D. | 次氯酸钠 |
分析 草木灰中含K2CO3,而贝壳的主要成分为CaCO3,在煅烧后生成CaO,即贝壳灰的主要成分为CaO,溶于水后生成Ca(OH)2,据此分析“灰”(草木灰)和“蜃”(贝壳灰)混合加水所得液体的成分.
解答 解:草木灰中含K2CO3,而贝壳的主要成分为CaCO3,在煅烧后生成CaO:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,即贝壳灰的主要成分为CaO,而CaO溶于水后生成Ca(OH)2:CaO+H2O=Ca(OH)2,故“灰”(草木灰)和“蜃”(贝壳灰)混合加水后发生反应:K2CO3+Ca(OH)2=CaCO3↓+2KOH.KOH是一种强碱,能使油脂发生水解从而能去油污,达到洗涤丝帛的目的,
故选C.
点评 本题结合史料考查了化学反应在生活中的应用,根据题干所给的信息并结合化学知识来解答,难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
14.某化学兴趣小组设计了如图所示的电化学装置:下列说法不正确的是( )
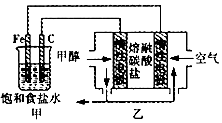

| A. | 乙池工作时,CO32-不断移向负极 | |
| B. | 乙池负极反应为CH3OH-6e-+3CO32-=4CO2+2H2O | |
| C. | 甲池中Fe电极发生的反应为2Cl--2e-=Cl2 | |
| D. | 为了使电池持续供电,工作时必须有CO2参与循环 |
13.下列实验操作、现象和结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 在Fe(NO3)2溶液中滴加酸化的H2O2 | 浅绿色变黄色 | H2O2具有氧化性 |
| B | 在酸性KMnO4溶液中滴加植物油 | 紫色变浅 | 植物油含有酯基 |
| C | 将稀硫酸滴入Na2CO3溶液中产生的气体通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明非金属性C>S>Si |
| D | 向淀粉水解液中加入适量银氨溶液后水浴加热 | 无银镜生成 | 不能判断淀粉是否水解 |
| A. | A | B. | B | C. | C | D. | D |
9.下列说法中正确的是( )
| A. | ⅠA族元素都是金属性很强的金属元素 | |
| B. | F是非金属性最强的元素 | |
| C. | 同族元素中得电子能力越强的电子层数越多 | |
| D. | 元素周期表中最右一列的元素通常具有强氧化性和可变化合价 |
16.NA表示阿伏伽德罗常数的值,下列叙述不正确的是( )
| A. | 60g SiO2晶体含4NA个σ键 | |
| B. | 1mol[Cu(NH3)4]2+中含4NA配位键 | |
| C. | 在24g石墨中,含C-C共价键数目为6NA | |
| D. | CO和N2是等电子体,标况下22.4L的CO气体与1mol N2所含的电子数相等 |
6.设 NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中,生成28 g N2时转移电子的数目为7.5 NA | |
| B. | 16.2 g纤维素完全燃烧,产生CO2分子的数目约为0.6 NA | |
| C. | 电解饱和食盐水产生11.2 L H2,则产生OH-的数目为0.1 NA | |
| D. | 1 L 0.1 mol•L-1NaHCO3溶液中含有HCO3-的数目为0.1 NA |
13.足量的金属锌与一定量稀硫酸反应,既能加快反应速率又不影响氢气的量.下列方法可行的是:( )
①加热 ②加入少量醋酸钠晶体 ③加入食盐水 ④加入少量浓硫酸 ⑤加入少量硫酸铜晶体 ⑥加入少量石墨 ⑦加入少量铜粉 ⑧加入少量镁粉.
①加热 ②加入少量醋酸钠晶体 ③加入食盐水 ④加入少量浓硫酸 ⑤加入少量硫酸铜晶体 ⑥加入少量石墨 ⑦加入少量铜粉 ⑧加入少量镁粉.
| A. | ①④⑤⑥⑦ | B. | ①⑤⑥⑦⑧ | C. | ②③④⑧ | D. | ①④⑤⑥⑦⑧ |
根据下表的数据,H2(g)+Cl2(g)==2HCl(g)的反应热应为( )
部分物质的键能
H2 | Cl2 | HCl | |
键能(kJ·mol-1) | 436 | 243 | 431 |
A.+183.0 kJ·mol-1 B.-366.0 kJ·mol-1
C.-183.0 kJ·mol-1 D.+211.0 kJ·mol-1