题目内容
3.取钠、镁、铝的单质各1g,分别与足量盐酸反应,产生氢气最快的是Na,产生氢气最多的是Al,反应中失电子数目最多的是Al.分析 金属性越强,与酸反应越剧烈,生成氢气越快;根据n=$\frac{m}{M}$计算出三者的物质的量及失去电子数,根据电子转移守恒,金属提供电子越多,相同条件下生成氢气越多,据此进行解答.
解答 解:金属性Na>Mg>Al,故Na与酸反应剧烈程度最大,产生氢气最快;
1g Na、Mg、Al的物质的量及失去电子分别为:n(Na)=$\frac{1g}{23g/mol}$=$\frac{1}{23}$mol,失去电子的物质的量为:$\frac{1}{23}$mol×1=$\frac{1}{23}$mol;
n(Mg)=$\frac{1g}{24g/mol}$=$\frac{1}{24}$mol,失去电子的物质的量为:$\frac{1}{24}$mol×2=$\frac{1}{12}$mol;
n(Al)=$\frac{1g}{27g/mol}$=$\frac{1}{27}$mol,失去电子的物质的量为:$\frac{1}{27}$mol×3=$\frac{1}{9}$mol;
根据计算可知,失去电子的物质的量最多的为Al,根据电子守恒,生成氢气的物质的量最多的也为Al,
故答案为:Na; Al;Al.
点评 本题考查了化学方程式的计算,题目难度不大,明确常见金属性质为解答关键,注意掌握守恒思想在化学计算中的应用是,试题培养了学生的化学计算能力.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
14.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 22.4L氮气中含NA个氮原子 | |
| B. | 在标准状况下,1mol水的体积约为22.4L | |
| C. | 0.3 mol•L-1Na2SO4溶液中含0.6NA个Na+ | |
| D. | 18 g水中所含的氢原子数目为2NA |
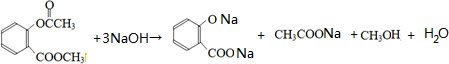
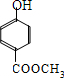
11.瑞香素具有消炎杀菌作用,结构如图所示,下列叙述正确的是( )
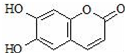

| A. | 与稀H2SO4混合加热不反应 | |
| B. | 不能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol 瑞香素最多能与3mol Br2发生反应 | |
| D. | 1mol瑞香素与足量的NaOH溶液发生反应时,消耗NaOH 2mol |
18. 如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )
如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )
 如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )
如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )| A. | 反应前后左室的压强相同 | |
| B. | 开始时左右两室中的分子数相同 | |
| C. | 反应后容器内的密度与反应前的相同 | |
| D. | 反应后容器内无O2存在 |
8.某溶液中可能含有Na+、Mg2+、Fe2+、H+、OH-、NO3-等几种离子中的若干种,向该溶液中加入氧化铝后,溶液中有X离子生成,下列判断中正确的是( )
| A. | 溶液中可以同时含有Fe2+、NO3- | B. | 溶液中一定有OH-、Na+ | ||
| C. | 溶液中可能含有Na+、H+、Mg2+、NO3- | D. | 若X是AlO2-,则上述离子最多有2种 |
15.与CH2═CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH≡CH→CH2═CHCN | B. | C2H5Cl→CH2═CH2 | ||
| C. | C6H6→C6H6-NO2 | D. | CH3COOH→CH3COOC2H5 |
12.某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子组合是( )
| A. | Mg2+ | B. | Mg2+、Fe2+ | C. | Fe2+ | D. | Mg2+、Al3+ |
13.下列关于1mo1•L-1的BaCl2溶液的叙述中.正确的是( )
| A. | 该溶液中C1-浓度为2mo1•L-1 | |
| B. | 该溶液中Ba2+的物质的量是1mo1 | |
| C. | 可使用250mL容量瓶分两次完成490mL该浓度的BaCl2溶液的配制 | |
| D. | 将208gBaCl2固体溶解在1L水中,形成的溶液的浓度为1mo1•L-1 |
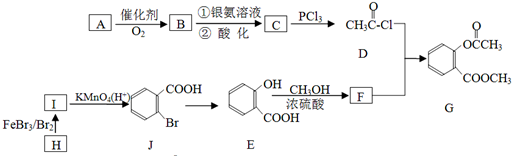
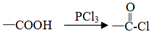
 ;
; ;
; ;
; .
.