题目内容
7.下列反应中,属于取代反应的是( )| A. | 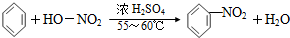 | |
| B. |  | |
| C. | 2 CH3CH2OH+O2 $→_{△}^{催化剂}$ 2 CH3CHO+2 H2O | |
| D. | CH2=CH2+HCl→CH3CH2Cl |
分析 有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应,以此解答.
解答 解:A.硝基替代苯环的氢原子,属于取代反应,故A正确;
B.为加聚反应,故B错误;
C.羟基被氧化生成醛基,属于氧化反应,故C错误;
D.C=C生成C-C,属于加成反应,故D错误.
故选A.
点评 本题考查有机物的结构和性质,侧重化学反应类型,为有机化学中高频考查,注意把握官能团的变化以及化学反应类型的判断,难度不大.

练习册系列答案
相关题目
18. 如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )
如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )
 如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )
如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )| A. | 反应前后左室的压强相同 | |
| B. | 开始时左右两室中的分子数相同 | |
| C. | 反应后容器内的密度与反应前的相同 | |
| D. | 反应后容器内无O2存在 |
15.与CH2═CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH≡CH→CH2═CHCN | B. | C2H5Cl→CH2═CH2 | ||
| C. | C6H6→C6H6-NO2 | D. | CH3COOH→CH3COOC2H5 |
2.某研究性学习小组以酸性KMnO4溶液和草酸(H2C2O4,二元弱酸)溶液为例,研究影响化学反应速率的因素,设计如表方案:
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)实验的记时方法是从溶液混合开始记时,至紫红色刚好褪去时,记时结束.
(3)实验①和②研究浓度对反应速率的影响,则V1=5.0mL,V2=3.0mL.
(4)下列有关该实验的叙述正确的是C、D.
A.实验时不能用量筒来量取液体的体积
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数.
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(5)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是反应生成的Mn2+对反应有催化作用.
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
(2)实验的记时方法是从溶液混合开始记时,至紫红色刚好褪去时,记时结束.
(3)实验①和②研究浓度对反应速率的影响,则V1=5.0mL,V2=3.0mL.
(4)下列有关该实验的叙述正确的是C、D.
A.实验时不能用量筒来量取液体的体积
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数.
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(5)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是反应生成的Mn2+对反应有催化作用.
12.某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子组合是( )
| A. | Mg2+ | B. | Mg2+、Fe2+ | C. | Fe2+ | D. | Mg2+、Al3+ |
19.下列各组离子在指定溶液中能大量共存的是( )
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在酸性溶液中:Mg2+、Na+、SO42-、Cl- | |
| C. | 加入 Al 能放出 H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 酸性溶液中:K+、Cl-、NO3-、Fe2+ |
16.下列一组粒子的中心原子杂化类型相同,分子或原子的键角不相等的是( )
| A. | SiCl4、金刚石 | B. | H2S、NF3 | C. | CH2═CHCl、环已烷 | D. | C6H6(苯)、CH3C≡CH |
金属钾和金属钠的金属性相近,但K比Na略强,当利用金属钠与KCl共熔制金属钾时,发现钾与钠的共熔体难以分离,如调整温度到一定程度,则可利用钠与KCl反应制取K,下面是四种物质的熔沸点:
K | Na | KCl | NaCl | |
熔点(℃) | 63.6 | 97.8 | 770 | 801 |
沸点(℃) | 774 | 882.9 | 1500 | 1413 |
根据平衡移动原理,可推知用Na与KCl反应制取金属钾的适宜温度是
A.低于770℃ B.850℃ C.高于882.9℃ D.1413~1500℃