题目内容
12.一直常温常压下:(1)Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s) ?H=-350KJ•mol-1
(2)2Ag(s)+$\frac{1}{2}$O2(g)=AgO(s) ?H=-25KJ•mol-1
则Zn(s)+AgO(s)=Zn(s)+2Ag(s)的△H( )
| A. | +135 KJ•mol-1 | B. | -375 KJ•mol-1 | C. | -325 KJ•mol-1 | D. | +325 KJ•mol-1 |
分析 根据已知的热化学反应方程式和目标反应,利用盖斯定律来计算目标反应的反应热,以此来解答.
解答 解:由:(1)Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s),△H=-350kJ•mol-1,
(2)2Ag(s)+$\frac{1}{2}$O2(g)=Ag2O(s),△H=-25.0kJ•mol-1,
根据盖斯定律可知,
(1)-(2)可得Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s),
则△H=(-350kJ•mol-1)-(-25.0kJ•mol-1)=-325kJ•mol-1,
故选C.
点评 本题考查学生利用盖斯定律计算反应的反应热,明确已知反应和目标反应的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
20.下列选项正确的是( )
| A. | 通常用来衡量一个国家的石油化学工业发展水平的标志是石油产量 | |
| B. | 只要存在离子键的化合物就是离子化合物 | |
| C. | NH3的电子式为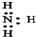 | |
| D. | 原电池中活泼的金属做正极 |
17.表示0.1mol/LNaHCO3溶液中有关微粒浓度的关系式中正确的是( )
| A. | c (Na+)>c (HCO3-)>c (CO32-)>c(H+)>c(OH-) | |
| B. | c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) | |
| C. | c (Na+)=c (HCO3-) | |
| D. | c (Na+)+c(H+)=c (HCO3-)+2c (CO32-)+c(OH-)+c(H2CO3) |
1.下表中实验操作、现象以及所得出的结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盛有2mL0.1mol/L AgNO3溶液的试管中,先滴加几滴0.1mol/L KCl溶液,再滴加0.1mol/L KI溶液 | 先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 将适量CO2和SO2分别通入装有Ba(NO3)2溶液的两支试管中 | 一支试管出现白色沉淀,另一支试管无明显现象 | 出现的白色沉淀是BaSO3 |
| C | 取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 | 产生白色沉淀 | KClO3中含Cl- |
| D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y可能是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
6.已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
| A. | 64g | B. | 32g | C. | 64g•mol-1 | D. | 32g•mol-1 |
 CH3COOCH2CH3+H2O;苯制取环己烷:
CH3COOCH2CH3+H2O;苯制取环己烷: .
.