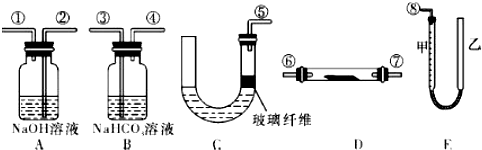
题目内容
3.下列物质的转化在给定条件下能实现的是( )①Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3
②S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4
③饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3
④Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3
⑤MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO.
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
分析 ①氧化铝与氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀;
②S与氧气反应生成的是二氧化硫;
③根据侯氏制碱法原理分析;
④加热氯化铁得到的是氢氧化铁,若充分加热最终得到氧化铁;
⑤氯化镁与石灰乳反应生成难溶物氢氧化镁,加热氢氧化镁可以获得氧化镁.
解答 解:①氧化铝与氢氧化钠溶液能够反应生成偏铝酸钠,偏铝酸钠与二氧化碳能够反应生成氢氧化铝沉淀,所以转化关系Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3能够实现,故①正确;
②S单质点燃生成的是SO2,不会生成三氧化硫,故②错误;
③根据侯氏制碱法可知,转化关系饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3可以实现,故③正确;
④氯化氢具有挥发性,加热促进了铁离子的水解,所以加入FeCl3(aq)无法获得FeCl3,得到的是氢氧化铁或氧化铁,故④错误;
⑤氢氧化镁更难溶,则MgCl2(aq)中加入石灰乳可以生成Mg(OH)2,加入氢氧化镁可以分解生成MgO,该转化关系可以实现,故⑤正确;
故选A.
点评 本题考查了常见金属元素单质及其化合物性质,题目难度中等,明确常见元素单质及其化合物性质为解答关键,④为易错点,注意加入氯化铁溶液无法获得氯化铁固体,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13. X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
(1)基态R原子的电子排布式为1s22s22p63s23p63d104s1.
(2)Y2分子中σ键和π键的数目比为1:2.
(3)X、Y、Z三种元素的第一电离能由小到大的顺序为C<O<N(用元素符合表示),元素Y的气态氢化物的沸点比元素X的气态氧化物沸点高的主要原因是氨气分子之间存在氢键.
(4)由元素Z、W组成的为了WZ43-的空间构型是正四面体,其中W原子的杂化物到类型为sp3杂化.
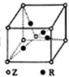
(5)已知Z、R能形成一种化合物,其晶胞结构如图所示,该化合物的化学式为Cu2O,若相邻的Z原子核R原子间的距离为a cm,设阿伏伽德罗常数的数值为NA,则该晶体的密度为$\frac{27\sqrt{3}}{2{a}^{3}{N}_{A}}$(用含a、NA的代数式表示)g•cm-1.
 X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:| 元素 | 相关信息 |
| X | 其中一种核素在考古时常用来鉴定一些文物的年代 |
| Y | 原子核外电子有7种不同的运动状态 |
| Z | 地壳中含量最高的元素 |
| W | 价电子排布式为(n+1)sn(n+1)p(n+1) |
| R | 基态原子最外能层只有一个电子,其他能层均已充满电子 |
(2)Y2分子中σ键和π键的数目比为1:2.
(3)X、Y、Z三种元素的第一电离能由小到大的顺序为C<O<N(用元素符合表示),元素Y的气态氢化物的沸点比元素X的气态氧化物沸点高的主要原因是氨气分子之间存在氢键.
(4)由元素Z、W组成的为了WZ43-的空间构型是正四面体,其中W原子的杂化物到类型为sp3杂化.
(5)已知Z、R能形成一种化合物,其晶胞结构如图所示,该化合物的化学式为Cu2O,若相邻的Z原子核R原子间的距离为a cm,设阿伏伽德罗常数的数值为NA,则该晶体的密度为$\frac{27\sqrt{3}}{2{a}^{3}{N}_{A}}$(用含a、NA的代数式表示)g•cm-1.
14.不同温度下,水溶液中c(H+)与c(OH-)关系如图所示.下列说法正确的是( )
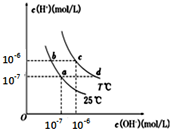

| A. | a点对应的溶液中大量存在:Na+、Mg2+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:Fe2+、Ba2+、Cl-、NO3- | |
| C. | c点对应的溶液中大量存在:K+、Al3+、Cl-、CO32- | |
| D. | d点对应的溶液中大量存在:Na+、NH4+、ClO-、Cl- |
11.常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验过程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述正确的是( )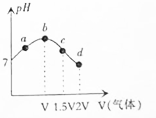

| A. | d点所示溶液中:c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| B. | a点到b点的过程中,溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | c点所示溶液中,c(CO32-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性 |
18.下列离子方程式正确的是( )
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| B. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | FeCl3溶液腐蚀印刷电路:Fe3++Cu=Fe2++Cu2+? |
8.不用其他试剂鉴别:①NaOH②KCl③Mg(NO3)2④CuSO4四种溶液,先直接鉴别出一种,再逐一鉴别其余物质,则正确的鉴别顺序是( )
| A. | ④①③② | B. | ①④③② | C. | ①③④② | D. | ④②①③ |
12.一直常温常压下:
(1)Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s) ?H=-350KJ•mol-1
(2)2Ag(s)+$\frac{1}{2}$O2(g)=AgO(s) ?H=-25KJ•mol-1
则Zn(s)+AgO(s)=Zn(s)+2Ag(s)的△H( )
(1)Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s) ?H=-350KJ•mol-1
(2)2Ag(s)+$\frac{1}{2}$O2(g)=AgO(s) ?H=-25KJ•mol-1
则Zn(s)+AgO(s)=Zn(s)+2Ag(s)的△H( )
| A. | +135 KJ•mol-1 | B. | -375 KJ•mol-1 | C. | -325 KJ•mol-1 | D. | +325 KJ•mol-1 |
13.已知S(s)+O2(g)=SO2(g)放出的热量为Q,下列说法正确的是( )
| A. | S(g)+O2(g)=SO2(g)放热为Q′,则Q′>Q | |
| B. | S(g)+O2(g)=SO2(g)放热为Q′,则Q′<Q | |
| C. | 1mol SO2(g)的能量>1mol S(s)的能量+1mol O2(g)的能量 | |
| D. | 1mol SO2(g)的能量<1mol S(s)的能量+1mol O2(g)的能量 |