题目内容
15.有一在空气中暴露过久的生石灰,经分析其中含氢氧化钙为a%,含碳酸钙b%,现取一定量的该固体,加入100mL1mol•L-1的盐酸中,为了反应掉过量的酸,需继续往反应后的溶液中加mg的原样品,由此可知蒸发中和后的溶液可得固体质量为( )| A. | 5.55g | B. | 7.55g | C. | 11.1g | D. | 无 |
分析 氢氧化钙与盐酸的反应方程式为Ca(OH)2+2HCl=CaCl2+2H2O,碳酸钙CaCO3与盐酸的反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,为了反应掉过量的酸,需继续往反应后的溶液中加mg的原样品,最后蒸干得到氯化钙,根据氯守恒分析解答.
解答 解:氢氧化钙与盐酸的反应方程式为Ca(OH)2+2HCl=CaCl2+2H2O,碳酸钙CaCO3与盐酸的反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,为了反应掉过量的酸,需继续往反应后的溶液中加mg的原样品,最后蒸干得到氯化钙,根据氯守恒,盐酸有0.1mol即Cl-有0.1mol,则CaCl2有0.05mol,所以可得固体质量为0.05×111=5.55g,故选A.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
5.下列关于铝的叙述中,正确的是( )
| A. | 铝是地壳中含量最多的元素 | |
| B. | 常温下,铝能与NaCl溶液发生置换反应 | |
| C. | 铝能溶解于冷浓硝酸中,生成硝酸铝 | |
| D. | 在化学反应中,铝容易失去电子,是还原剂 |
3.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
(1)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=1×10-5mol•L-1;从第②组情况表明,c>(填“>”“<”或“=”)0.2mol•L-1;从第③组情况分析可知,混合溶液中c(NH4+)>(填“>”“<”或“=”)c(NH3•H2O).
(2)以下四组溶液NH4+浓度由大到小的顺序为B>D>A>C(填选项编号).
A.0.1mol•L-1 NH4Cl B.0.1mol•L-1 NH4Cl和0.1mol•L-1 NH3•H2O
C.0.1mol•L-1 NH3•H2O D.0.1mol•L-1 NH4Cl和0.1mol•L-1 HCl.
| 编号 | 氨水浓度/(mol•L-1) | 盐酸浓度/(mol•L-1) | 混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
(2)以下四组溶液NH4+浓度由大到小的顺序为B>D>A>C(填选项编号).
A.0.1mol•L-1 NH4Cl B.0.1mol•L-1 NH4Cl和0.1mol•L-1 NH3•H2O
C.0.1mol•L-1 NH3•H2O D.0.1mol•L-1 NH4Cl和0.1mol•L-1 HCl.
10.可逆反应在一定条件下达到化学平衡时,下列说法正确的是( )
| A. | 正反应速率等于逆反应速率,且都为零 | |
| B. | 反应物和生成物浓度相等 | |
| C. | 反应体系中混合物的组成保持不变 | |
| D. | 断开化学键吸收的能量等于形成化学键所放出的能量. |
9.NaCl是一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是( )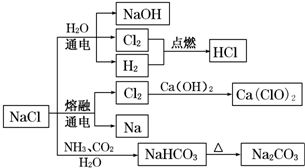

| A. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | NaHCO3 受热分解的方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | |
| C. | 电解饱和氯化钠溶液的方程式为:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | |
| D. | 图中所示转化反应都是氧化还原反应 |
10.下列有关金属及其化合物的说法正确的是( )
| A. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al | |
| B. | 可以用铝热反应来制取镁 | |
| C. | 铁在高温下与水蒸气反应生成Fe2O3和H2 | |
| D. | Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3 |
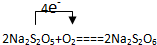 ;
; .
.