题目内容
4.根据下列离子方程式,各写一个符合条件的化学方程式①Fe+2H+═Fe2++H2↑Fe+2HCl=FeCl2+H2↑
②HCO3-+H+═CO2↑+H2O.NaHCO3+HCl=NaCl+CO2↑+H2O.
分析 ①Fe+2H+═Fe2++H2↑可以表示铁与强酸反应生成可溶性亚铁盐和氢气的反应;
②HCO3-+H+═CO2↑+H2O可以表示可溶性碳酸氢盐与强酸反应生成二氧化碳、水和可溶性盐的反应.
解答 解:①Fe+2H+═Fe2++H2↑可以表示铁与强酸反应生成可溶性亚铁盐和氢气的反应,例如:铁与盐酸反应生成氯化亚铁和氢气,化学方程式:Fe+2HCl=FeCl2+H2↑,
故答案为:Fe+2HCl=FeCl2+H2↑;
②HCO3-+H+═CO2↑+H2O可以表示可溶性碳酸氢盐与强酸反应生成二氧化碳、水和可溶性盐的反应,例如:碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,化学方程式:NaHCO3+HCl=NaCl+CO2↑+H2O,
故答案为:NaHCO3+HCl=NaCl+CO2↑+H2O;
点评 本题考查了离子方程式书写,明确离子方程式的意义及书写方法是解题 关键,注意化学式拆分,题目难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
9.做焰色反应实验用的铂丝,每试验一种样品后都必须进行的操作是( )
| A. | 用水洗涤2~3次后再使用 | |
| B. | 用滤纸擦干后才可使用 | |
| C. | 用盐酸洗涤后,经蒸馏水冲洗,方可使用 | |
| D. | 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用 |
10.可逆反应在一定条件下达到化学平衡时,下列说法正确的是( )
| A. | 正反应速率等于逆反应速率,且都为零 | |
| B. | 反应物和生成物浓度相等 | |
| C. | 反应体系中混合物的组成保持不变 | |
| D. | 断开化学键吸收的能量等于形成化学键所放出的能量. |
9.NaCl是一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是( )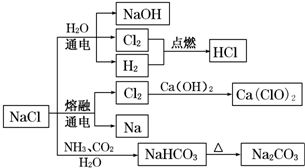

| A. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | NaHCO3 受热分解的方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | |
| C. | 电解饱和氯化钠溶液的方程式为:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | |
| D. | 图中所示转化反应都是氧化还原反应 |
16.将某些化学知识用图象表示,可以收到直观、简明的效果.下列图象所表示的化学知识中,明显不正确的是( )
| A. |  分散系的分类 | |
| B. |  稀释浓盐酸的过程 | |
| C. |  向碳酸钠溶液中逐滴滴入盐酸 | |
| D. |  向氯化铝溶液中滴加氢氧化钠至过量 |
13.下列关于铝的性质和用途描述正确的是( )
| A. | 铝能与所有的酸和碱反应放出氢气 | |
| B. | 用酒精灯外焰加热铝箔,可以看到少量液滴悬而不落,说明铝的熔点比氧化铝高 | |
| C. | 铝合金质轻,强度大,耐腐蚀,可以用作门窗 | |
| D. | 氢氧化铝能溶于氨水 |
14.下列应用或解释合理的是( )
| A. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| B. | SO2具有漂白性,可使紫色石蕊试液褪为无色 | |
| C. | 丁达尔效应是区分胶体和溶液的一种常用物理方法 | |
| D. | 在实验室里,常用电解饱和食盐水的方法制取氯气 |
 .
.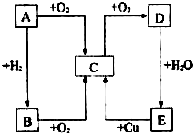 如图所示,A、B、C、D、E五种物质的相互转化关系,B能使紫色石蕊试纸变蓝.请回答:
如图所示,A、B、C、D、E五种物质的相互转化关系,B能使紫色石蕊试纸变蓝.请回答: