题目内容
实验室电解饱和食盐水(含酚酞),装置如图所示,有毒气体收集的装置省略没有画出,两电极均是惰性电极.
(1)电解过程中观察到a电极上的现象为 ;
(2)确定N出口的气体最简单的方法是 .
(3)电解的总反应离子方程式为 .
(4)若更换电解液及电极,将该装置用于电解精炼铜,则a电极的材料为 ,写出b的电极反应式: .
(5)若将b电极换成铁作电极,电解液仍为NaCl溶液,写出b电极的电极反应式: ,若过程中发现在电解过程中U型管底部出现白色沉淀产生,很快变为灰绿色,最终变为红褐色的现象,请写出由白色沉淀转化为红褐色沉淀的化学方程式: .
(1)电解过程中观察到a电极上的现象为
(2)确定N出口的气体最简单的方法是
(3)电解的总反应离子方程式为
(4)若更换电解液及电极,将该装置用于电解精炼铜,则a电极的材料为

(5)若将b电极换成铁作电极,电解液仍为NaCl溶液,写出b电极的电极反应式:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)根据电子移动方向知,a是阴极、b是阳极,a电极上氢离子放电生成氢气,同时阴极附近有氢氧根离子生成,导致溶液呈碱性;
(2)b电极上氯离子放电生成氯气,氯气具有强氧化性,能使湿润的淀粉碘化钾试纸变蓝色;
(3)电解时阳极上生成氯气、阴极上生成氢气,同时阴极附近还有NaOH生成;
(4)电解精炼粗铜时,粗铜作阳极、纯铜作阴极,电解质溶液为硫酸铜溶液;
(5)若将b电极换成铁作电极,电解液仍为NaCl溶液,b电极上铁失电子发生氧化反应,阴极附近生成氢氧根离子,亚铁离子和氢氧根离子生成Fe(OH)2白色沉淀,Fe(OH)2被氧化生成红褐色的Fe(OH)3.
(2)b电极上氯离子放电生成氯气,氯气具有强氧化性,能使湿润的淀粉碘化钾试纸变蓝色;
(3)电解时阳极上生成氯气、阴极上生成氢气,同时阴极附近还有NaOH生成;
(4)电解精炼粗铜时,粗铜作阳极、纯铜作阴极,电解质溶液为硫酸铜溶液;
(5)若将b电极换成铁作电极,电解液仍为NaCl溶液,b电极上铁失电子发生氧化反应,阴极附近生成氢氧根离子,亚铁离子和氢氧根离子生成Fe(OH)2白色沉淀,Fe(OH)2被氧化生成红褐色的Fe(OH)3.
解答:
解:(1)根据电子移动方向知,a是阴极、b是阳极,a电极上氢离子放电生成氢气,同时阴极附近有氢氧根离子生成,导致溶液呈碱性,无色酚酞试液遇碱变红色,所以看到的现象是:有气泡产生且溶液变红色,故答案为:有气泡产生且溶液变红色;
(2)N出口的气体是氯气,氯气能置换出碘化钾中的碘,碘能使淀粉变蓝色,所以可用湿润的淀粉碘化钾检验.
故答案为:用湿润的淀粉碘化钾试纸检验,试纸变蓝则说明是Cl2;
(3)电解时阳极上生成氯气、阴极上生成氢气,同时阴极附近还有NaOH生成,离子方程式为2Cl-+2H2O
Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
(4)电解精炼粗铜时,粗铜作阳极、纯铜作阴极,电解质溶液为硫酸铜溶液,所以a极材料是纯铜,b电极上电极反应式为Cu-2e-=Cu 2+,
故答案为:纯铜;Cu-2e-=Cu 2+;
(5)若将b电极换成铁作电极,电解液仍为NaCl溶液,b电极上铁失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,阴极附近生成氢氧根离子,亚铁离子和氢氧根离子生成Fe(OH)2白色沉淀,Fe(OH)2被氧化生成红褐色的Fe(OH)3,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:Fe-2e-=Fe2+;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)N出口的气体是氯气,氯气能置换出碘化钾中的碘,碘能使淀粉变蓝色,所以可用湿润的淀粉碘化钾检验.
故答案为:用湿润的淀粉碘化钾试纸检验,试纸变蓝则说明是Cl2;
(3)电解时阳极上生成氯气、阴极上生成氢气,同时阴极附近还有NaOH生成,离子方程式为2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
(4)电解精炼粗铜时,粗铜作阳极、纯铜作阴极,电解质溶液为硫酸铜溶液,所以a极材料是纯铜,b电极上电极反应式为Cu-2e-=Cu 2+,
故答案为:纯铜;Cu-2e-=Cu 2+;
(5)若将b电极换成铁作电极,电解液仍为NaCl溶液,b电极上铁失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,阴极附近生成氢氧根离子,亚铁离子和氢氧根离子生成Fe(OH)2白色沉淀,Fe(OH)2被氧化生成红褐色的Fe(OH)3,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:Fe-2e-=Fe2+;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查了电解池原理,明确物质的性质及离子放电顺序是解本题关键,难点是电极反应式的书写,注意活泼金属作阳极时,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.

练习册系列答案
相关题目
下列关于有机物的表述正确的是( )
| A、油脂、淀粉、蛋白质均为可水解的高分子化合物 | ||||
| B、乙烯、苯、乙酸分子中的所有原子都在同一平面上 | ||||
| C、石油催化裂化的主要目的是为了获得汽油等轻质油 | ||||
D、实验室中制取乙酸乙酯的化学方程式为CH3COOH+H18OC2H5
|
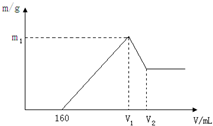 将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:
 (不考虑立体结构,其中R为
(不考虑立体结构,其中R为 ).M的一条合成路线如下(部分反应试剂和条件省略).
).M的一条合成路线如下(部分反应试剂和条件省略).
 与
与 的化学性质相似.
的化学性质相似. :
: :
: :
: