题目内容
在x R++yH++O2=m R2++nH2O离子反应方程式中,m值是( )
| A、2x | B、4 | C、3 | D、2 |
考点:氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:反应xR2++yH++O2=mR3++nH2O中,R的化合价升高,被氧化,O的化合价降低,被还原,根据氧化还原反应得失电子数目相等配平化学方程式,可求m值.
解答:
解:解法一:反应xR2++yH++O2=mR3++nH2O中,R的化合价有+2价升高为+3价,被氧化,O的化合价由0价降低降低到-2价,被还原,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等,可配平反应的方程式为4R2++4H++O2=4R3++2H2O,
则m=4,
解法二:由质量守恒可得x=m,
由氧化还原反应得失电子守恒可得2×(2-0)=m×(3-2),
m=4,
故选B.
则m=4,
解法二:由质量守恒可得x=m,
由氧化还原反应得失电子守恒可得2×(2-0)=m×(3-2),
m=4,
故选B.
点评:本题考查氧化还原反应,题目难度不大,注意从质量守恒和得失电子的角度解答,或直接配平方程式,也可得出m.

练习册系列答案
相关题目
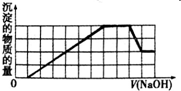 某溶液中可能含有H+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有H+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示.下列说法正确的是( )| A、原溶液中含有的阳离子只有H+、Fe3+、Al3+ |
| B、原溶液中一定含有SO42-和Na+ |
| C、原溶液中含有的Fe3+和Al3+的物质的量之比为l:l |
| D、反应最后形成的溶液中溶质只有Na2SO4 |
欲除去下列物质中混入的少量杂质(括号内物质为杂质),错误的是( )
| A、乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 |
| B、乙醇(水):加入新制生石灰,蒸馏 |
| C、溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
| D、乙酸(乙醇):加入金属钠,蒸馏 |
下列有关化学与生活说法中,正确的是( )
A、 是世界通用的循环再生标志,简称回收标志 是世界通用的循环再生标志,简称回收标志 |
| B、含有食品添加剂的食品对人体健康均有害,不宜食用 |
| C、硫、氮的氧化物会造成酸雨,酸雨指pH小于7的雨水 |
| D、明矾是常用的水处理剂,可用于城市自来水的杀菌消毒 |
2001年11月,美军向躲藏在山洞的阿富汗恐怖分子使用了一种名为BLU-82的燃料炸弹,这种炸弹爆炸时能耗尽山洞中的氧气,使洞中的生物窒息死亡.该炸弹的主装药之一是环氧乙烷(化学式为C2H4O).关于环氧乙烷的下列说法正确的是( )
| A、它是化合物 |
| B、它是含有3种元素的混合物 |
| C、它的相对分子质量为44 |
| D、它在空气中充分燃烧只生成CO2 |
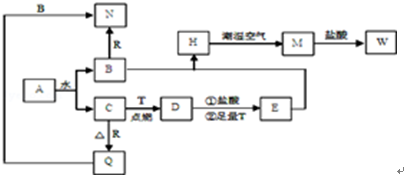
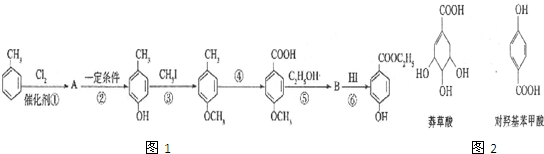
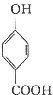 生成C7H5O3Na的化学反应方程式
生成C7H5O3Na的化学反应方程式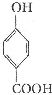 所有同分异构体的结构简式
所有同分异构体的结构简式