题目内容
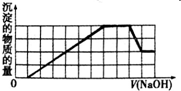 某溶液中可能含有H+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有H+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示.下列说法正确的是( )| A、原溶液中含有的阳离子只有H+、Fe3+、Al3+ |
| B、原溶液中一定含有SO42-和Na+ |
| C、原溶液中含有的Fe3+和Al3+的物质的量之比为l:l |
| D、反应最后形成的溶液中溶质只有Na2SO4 |
考点:离子方程式的有关计算
专题:
分析:根据图象曲线变化可知,加入氢氧化钠溶液时没有立刻生成沉淀,说明溶液中含有H+;之后氢氧化钠溶液与金属离子反应生成沉淀,之后沉淀不变,最后沉淀部分溶解,则溶液中一定含有Fe3+、Al3+和NH4+,最终得到沉淀为氢氧化铁,沉淀溶解部分为氢氧化铝,沉淀不变的部分为铵根离子与氢氧根离子反应生成一水合氨;根据离子共存可知,溶液中一定不存在CO32-,结合溶液电中性可知,溶液中一定存在SO42-,据此进行解答.
解答:
解:根据图象曲线变化可知,加入氢氧化钠溶液时没有立刻生成沉淀,说明溶液中含有H+;之后氢氧化钠溶液与金属离子反应生成沉淀,之后沉淀不变,最后沉淀部分溶解,则溶液中一定含有Fe3+、Al3+和NH4+,最终得到沉淀为氢氧化铁,沉淀溶解部分为氢氧化铝,沉淀不变的部分为铵根离子与氢氧根离子反应生成一水合氨;根据离子共存可知,溶液中一定不存在CO32-,结合溶液电中性可知,溶液中一定存在SO42-,
A.根据分析可知,原溶液中含有的阳离子为:H+、NH4+、Fe3+、Al3+,故A错误;
B.原溶液中一定含有硫酸根离子,不一定含有钠离子,故B错误;
C.根据图象曲线变化可知,剩余氢氧化铁沉淀的物质的量与溶解的氢氧化铝的物质的量相等,说明原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,故C正确;
D.根据溶液中的离子的存在情况可知道,最后溶液中含有的溶质除了Na2SO4,还有偏铝酸钠,故D错误;
故选C.
A.根据分析可知,原溶液中含有的阳离子为:H+、NH4+、Fe3+、Al3+,故A错误;
B.原溶液中一定含有硫酸根离子,不一定含有钠离子,故B错误;
C.根据图象曲线变化可知,剩余氢氧化铁沉淀的物质的量与溶解的氢氧化铝的物质的量相等,说明原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,故C正确;
D.根据溶液中的离子的存在情况可知道,最后溶液中含有的溶质除了Na2SO4,还有偏铝酸钠,故D错误;
故选C.
点评:本题考查了离子反应的计算、离子共存的判断,题目难度中等,试题考查范围广,明确氢氧化铝是两性氢氧化物溶于强碱是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学反应中属于氮的固定的是( )
A、N2+O2
| ||||
| B、O2+2NO=2NO2 | ||||
| C、H2O+3NO2═NO+2HNO3 | ||||
D、4NH3+5O2
|
如图是四种常见有机物的比例模型示意图.下列说法不正确的是( )

| A、甲能使酸性高锰酸钾溶液褪色 |
| B、乙能与溴水发生加成反应使溴水褪色 |
| C、丙分子中所有原子均在同一平面上 |
| D、丁在浓硫酸作用下可与乙酸发生取代反应 |
已知:①H2O(g)═H2O(l);△H1=-Q1kJ/mol
②C2H5OH(g)═C2H5OH(l);△H2=-Q2kJ/mol
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=-Q3kJ/mol
若使23g液态酒精完全燃烧,最后恢复到室温,则放出的热量为( )(kJ)
②C2H5OH(g)═C2H5OH(l);△H2=-Q2kJ/mol
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=-Q3kJ/mol
若使23g液态酒精完全燃烧,最后恢复到室温,则放出的热量为( )(kJ)
| A、0.5Q2-0.5Q3-1.5Q1 |
| B、1.5Q1-0.5Q2+0.5Q3 |
| C、0.5Q1-1.5Q2+0.5Q3 |
| D、0.5(Q1+Q2+Q3) |
在x R++yH++O2=m R2++nH2O离子反应方程式中,m值是( )
| A、2x | B、4 | C、3 | D、2 |
下列实验操作过程中需要使用圆底烧瓶的是( )
| A、过滤 | B、蒸馏 | C、溶解 | D、分液 |
实验室用NaOH固体和蒸馏水准确配制一定物质的量浓度的NaOH溶液.以下仪器中,不需要用到的是( )
| A、烧杯 | B、玻璃棒 |
| C、容量瓶 | D、蒸馏烧瓶 |
下列除去杂质(括号内的物质为杂质)的方法中,错误的是( )
| A、FeCl3溶液(FeCl2):通入适量Cl2 |
| B、CO(CO2):通过NaOH溶液洗气后干燥 |
| C、SiO2(KCl):加水溶解后过滤、洗涤、干燥 |
| D、SO2(HCl):通过饱和Na2SO3溶液洗气后干燥 |

