题目内容
欲除去下列物质中混入的少量杂质(括号内物质为杂质),错误的是( )
| A、乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 |
| B、乙醇(水):加入新制生石灰,蒸馏 |
| C、溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
| D、乙酸(乙醇):加入金属钠,蒸馏 |
考点:物质的分离、提纯的基本方法选择与应用
专题:化学实验基本操作
分析:A.乙酸乙酯难溶于饱和碳酸钠溶液,而乙酸可被碳酸钠溶液吸收;
B.新制生石灰与水反应生成氢氧化钙;
C.溴苯不溶于水,溴可与氢氧化钠反应;
D.乙酸和乙醇与金属钠都反应.
B.新制生石灰与水反应生成氢氧化钙;
C.溴苯不溶于水,溴可与氢氧化钠反应;
D.乙酸和乙醇与金属钠都反应.
解答:
解:A.乙酸与碳酸钠反应而被吸收,但乙酸乙酯不溶于水饱和碳酸钠溶液,所以乙酸乙酯中混有乙酸,可用饱和碳酸钠溶液分离,故A正确;
B.新制生石灰与水反应生成氢氧化钙,蒸馏时,可得到较为纯净的乙醇,故B正确;
C.溴可与氢氧化钠反应,且溴苯不溶于水,可用氢氧化钠溶液除杂,故C正确;
D.乙酸和乙醇与金属钠都反应,不能用加金属钠的方法分离,可蒸馏分离,故D错误.
故选D.
B.新制生石灰与水反应生成氢氧化钙,蒸馏时,可得到较为纯净的乙醇,故B正确;
C.溴可与氢氧化钠反应,且溴苯不溶于水,可用氢氧化钠溶液除杂,故C正确;
D.乙酸和乙醇与金属钠都反应,不能用加金属钠的方法分离,可蒸馏分离,故D错误.
故选D.
点评:本题考查物质的分离、提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大,注意根据除杂质的原则判断,所选除杂剂只能和杂质反应,不能和原物质反应,除掉杂质的同时,不能引入新的杂质.通常把杂质转化为可溶物、沉淀或气体便于和原物质分离,从而达到混合物分离的目的.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+) |
| B、常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)=c(OH-) |
| C、常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7 mol?L-1 |
| D、物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
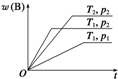 密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、T1<T2,p1<p2,a+b>c,正反应为吸热反应 |
| B、T1>T2,p1<p2,a+b<c,正反应为吸热反应 |
| C、T1<T2,p1>p2,a+b<c,正反应为吸热反应 |
| D、T1>T2,p1>p2,a+b>c,正反应为放热反应 |
在x R++yH++O2=m R2++nH2O离子反应方程式中,m值是( )
| A、2x | B、4 | C、3 | D、2 |
向恒温恒容密闭容器中加入1molHI,发生下列反应2HI(g)═H2(g)+I2(g),△H>0.达到平衡后,往容器中再加入1molHI,有关说法正确的是( )
| A、平衡不移动,HI平衡转化率不变 |
| B、平衡向右移动,HI平衡转化率不变 |
| C、平衡向左移动,HI平衡转化率减小 |
| D、平衡向右移动,HI平衡转化率增大 |
与氢气完全加成后,能生成2-甲基丁烷的烃是( )
| A、CH2=CH-CH2-CH3 |
| B、CH2=C(CH3) CH=CH2 |
| C、(CH3)2CHCH=CH2 |
| D、(CH3)3CCH═CH2 |
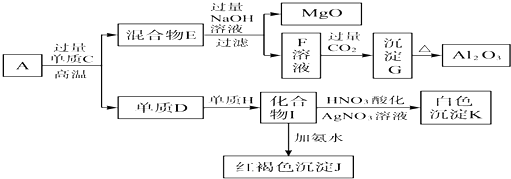
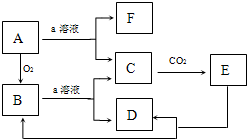 如图物质的转化关系中,A为难熔固体单质,E为一种白色不溶物,a是焰色反应呈黄色的强碱溶液.据此回答:
如图物质的转化关系中,A为难熔固体单质,E为一种白色不溶物,a是焰色反应呈黄色的强碱溶液.据此回答: