题目内容
用NA表示阿伏加德罗常数,下列判断正确的是( )
| A、常温常压下,16g O2和O3的混合气体中含有NA个氧原子 |
| B、常温常压下,28 g CO与22.4 L O2的分子数都是NA个 |
| C、16 g CH4与18 g NH4+所含质子数都是10NA个 |
| D、1 mol/L Na2CO3溶液中,CO32-的离子数目小于NA个 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氧气和臭氧中都只含有氧原子,16g混合物中含有16g氧原子,含有1mol氧原子;
B.常温常压下,不能使用标况下的气体摩尔体积计算氧气的物质的量;
C.铵根离子中含有11个质子,甲烷中含有10个质子;
D.缺少碳酸钠溶液的体积,无法计算碳酸根离子的数目.
B.常温常压下,不能使用标况下的气体摩尔体积计算氧气的物质的量;
C.铵根离子中含有11个质子,甲烷中含有10个质子;
D.缺少碳酸钠溶液的体积,无法计算碳酸根离子的数目.
解答:
解:A.16g氧气和臭氧的混合物中含有16g氧原子,16g氧原子的物质的量为1mol,混合气体中含有NA个氧原子,故A正确;
B.不是标况下,不能使用标况下的气体摩尔体积计算22.4L氧气的物质的量,故B错误;
C.16g甲烷的物质的量为1mol,含有10mol质子;18g铵根离子的物质的量为1mol,含有11mol质子,二者含有的质子数不同,故C错误;
D.没有告诉碳酸钠溶液的体积,题中体积无法计算碳酸根离子数目,故D错误;
故选A.
B.不是标况下,不能使用标况下的气体摩尔体积计算22.4L氧气的物质的量,故B错误;
C.16g甲烷的物质的量为1mol,含有10mol质子;18g铵根离子的物质的量为1mol,含有11mol质子,二者含有的质子数不同,故C错误;
D.没有告诉碳酸钠溶液的体积,题中体积无法计算碳酸根离子数目,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项D为易错点,注意题中缺少溶液的体积.

练习册系列答案
相关题目
分子式为C5H12O的醇与C5H10O2的酸发生酯化反应最多可形成多少种酯( )
| A、8种 | B、16种 |
| C、24种 | D、32种 |
a、b、c、d是四种短周期的主族元素.其中d的质子数最大,a、b、d同周期;a、c同主族. a的原子结构示意图为: ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: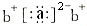 .下列叙述正确的是( )
.下列叙述正确的是( )
 ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: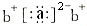 .下列叙述正确的是( )
.下列叙述正确的是( )| A、原子半径:a>c>d |
| B、非金属性:c>a>d |
| C、相应氢化物的沸点:d>c>a |
| D、c与a、c与b均能形成两种化合物 |
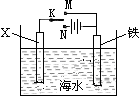 已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )
已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )| A、X为锌棒,K置于M,可减缓铁的腐蚀,铁电极上发生的反应为2H++2e-=H2↑ |
| B、X为锌棒,K置于M,外电路电流方向是从X到铁 |
| C、X为碳棒,K置于N,可减缓铁的腐蚀,利用的是外加电流的阴极保护法 |
| D、X为碳棒,K置于N,在X电极周围首先失电子的是Cl- |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B、常温常压下,22 g 14CO2中所含分子数为0.5NA |
| C、室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D、7.8g Na2O2与足量水反应,转移电子数为0.2NA |
以NA表示阿伏加德罗常数,下列说法正确的是( )
| A、25℃,101KPa条件下,24.5L的N2和CO混合气体含有的原子数大于2NA | ||
| B、15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA | ||
| C、1 mol SiO2中含有2 mol Si-O单键 | ||
D、14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为
|
等质量的O2和CO2相比较,下列叙述正确的是( )
| A、体积比为11:8 |
| B、分子个数之比为1:1 |
| C、物质的量之比为11:8 |
| D、原子个数之比为12:11 |
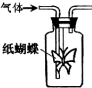 如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )
如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )