题目内容
以NA表示阿伏加德罗常数,下列说法正确的是( )
| A、25℃,101KPa条件下,24.5L的N2和CO混合气体含有的原子数大于2NA | ||
| B、15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA | ||
| C、1 mol SiO2中含有2 mol Si-O单键 | ||
D、14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为
|
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、25℃,101KPa条件下,气体摩尔体积是24.5L/mol,因此N2和CO混合气体含有的原子数等于2NA;
B、Na2O2与CO2反应时,1mol Na2O2转移1mol电子,所以15.6 g Na2O2转移的电子数为0.2 NA;
C、1 mol SiO2中含有4 mol Si-O单键;
D、CnH2n分子中含有1个C=C,所以14gCnH2n含有的C=C的数目一定为
.
B、Na2O2与CO2反应时,1mol Na2O2转移1mol电子,所以15.6 g Na2O2转移的电子数为0.2 NA;
C、1 mol SiO2中含有4 mol Si-O单键;
D、CnH2n分子中含有1个C=C,所以14gCnH2n含有的C=C的数目一定为
| NA |
| n |
解答:
解:A、25℃,101KPa条件下,气体摩尔体积是24.5L/mol,因此N2和CO混合气体含有的原子数等于2NA,故A错误;
B、Na2O2与CO2反应时,1mol Na2O2转移1mol电子,所以15.6 g Na2O2转移的电子数为0.2 NA,故B错误;
C、1 mol SiO2中含有4 mol Si-O单键,故C错误;
D、CnH2n分子中含有1个C=C,所以14gCnH2n含有的C=C的数目一定为为
,故D正确;
故选D.
B、Na2O2与CO2反应时,1mol Na2O2转移1mol电子,所以15.6 g Na2O2转移的电子数为0.2 NA,故B错误;
C、1 mol SiO2中含有4 mol Si-O单键,故C错误;
D、CnH2n分子中含有1个C=C,所以14gCnH2n含有的C=C的数目一定为为
| NA |
| n |
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
相关题目
化学与社会、环境密切相关,下列有关说法正确的是( )
| A、绿色化学的核心是应用化学原理对环境污染进行治理 |
| B、氯气和氢氧化钠溶液和石灰乳得到的含氯化合物都具有漂白性 |
| C、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| D、对“地沟油”蒸馏可以获得汽油 |
用NA表示阿伏加德罗常数,下列判断正确的是( )
| A、常温常压下,16g O2和O3的混合气体中含有NA个氧原子 |
| B、常温常压下,28 g CO与22.4 L O2的分子数都是NA个 |
| C、16 g CH4与18 g NH4+所含质子数都是10NA个 |
| D、1 mol/L Na2CO3溶液中,CO32-的离子数目小于NA个 |
化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
| B、铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| C、绿色化学的核心是从源头上消除工业生产对环境的污染 |
| D、用CO2合成聚碳酸酯可降解塑料,可实现“碳”的循环利用 |
下列有关化学用语中正确的是( )
| A、次氯酸分子的结构式:H-O-Cl |
B、聚丙烯的结构简式为: |
C、氮分子的结构式: |
D、丙烷分子的比例模型: |
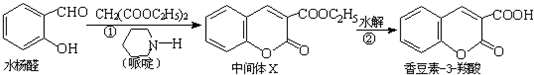
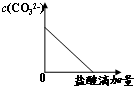
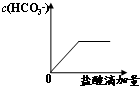

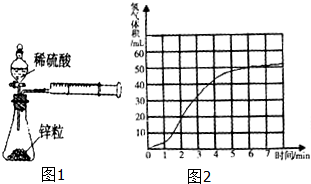 某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.
某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.