题目内容
11.在反应KNO2$\stackrel{△}{→}$K2O+NO↑+O2↑(未配平)中,当生成33.6L NO(标准状况)时,被氧化的氧原子的物质的量为( )| A. | 3 mol | B. | 1.5 mol | C. | 0.75 mol | D. | 0.6 mol |
分析 反应中N元素化合价降低,O元素化合价升高,根据化合价的变化结合氧化还原反应中得失电子相等进行计算.
解答 解:反应中N元素化合价由+3价降低到+2价,生成33.6LNO(标准状况),n(NO)=1.5mol,则得到电子1.5mol×(3-2)=1.5mol,
反应中O元素的化合价由-2价升高到0价,则被氧化的原子的物质的量为$\frac{1.5}{2-0}$mol=0.75mol,
故选C.
点评 本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,注意把握氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降总数相等,难度不大.

练习册系列答案
相关题目
2.水泥是以石灰石和黏土为主要原料制成的硅酸盐产品.含有三种主要成分,下列哪种不在其中( )
| A. | .硅酸三钙 | B. | .碳酸二钙 | C. | 铝酸三钙 | D. | .碳酸钙 |
19.下列各组物质既不是同系物,也不是同分异构体,但最简式相同是( )
| A. | 1,2-二溴乙烷和1,1-二氯丙烷 | B. | 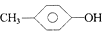 和 和 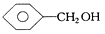 | ||
| C. | 苯 和 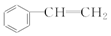 | D. | 丙炔 和 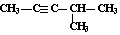 |
16.下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 二氧化硅可以和NaOH溶液及HF溶液反应 | 二氧化硅属于两性氧化物 |
| B | 二氧化硫能漂白有色布料 | 二氧化硫具有强氧化性 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝的熔点高 |
| A. | A | B. | B | C. | C | D. | D |
3.下列各溶液中,Na+物质的量浓度最大的是( )
| A. | 4L、0.5mol/L NaCl溶液 | B. | 1L、0.3mol/L Na2SO4溶液 | ||
| C. | 5L、0.4 mol/L NaOH溶液 | D. | 2L、0.15 mol/L、Na3PO4溶液 |
20.下列物质中,既能跟盐酸反应,又能跟NaOH溶液反应的化合物是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3⑤Fe(OH)3 ⑥Fe2O3.
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3⑤Fe(OH)3 ⑥Fe2O3.
| A. | ①②③④ | B. | ②③④ | C. | ①③④⑤ | D. | ①②④⑥ |
1.下列关于电解质的叙述正确的是( )
| A. | 易溶于水的电解质一定是强电解质 | |
| B. | 强电解质在水溶液中以离子形式存在 | |
| C. | 难溶于水的电解质一定是弱电解质 | |
| D. | 强电解质溶液的导电性一定比弱电解质强 |