题目内容
3.下列各溶液中,Na+物质的量浓度最大的是( )| A. | 4L、0.5mol/L NaCl溶液 | B. | 1L、0.3mol/L Na2SO4溶液 | ||
| C. | 5L、0.4 mol/L NaOH溶液 | D. | 2L、0.15 mol/L、Na3PO4溶液 |
分析 结合溶质浓度、溶质构成计算离子浓度,离子浓度等于溶质溶液与离子个数的乘积,以此来解答.
解答 解:A.Na+物质的量浓度为0.5mol/L;
B.Na+物质的量浓度为0.3mol/L×2=0.6mol/L;
C.Na+物质的量浓度为0.4mol/L;
D.Na+物质的量浓度为0.15mol/L×3=0.45mol/L,
显然B中最大,
故选B.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质的构成、离子浓度的计算为解答的关键,侧重分析与计算能力的考查,注意离子浓度与溶液体积无关,题目难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
14.关于钠及其氧化物性质的叙述中,正确的是( )
| A. | Na能与CuSO4溶液反应置换出红色的铜 | |
| B. | Na2O是碱性氧化物,与酸反应生成盐和水 | |
| C. | Na2O和Na2O2都能与水反应,生成物完全相同 | |
| D. | Na2O2是白色固体,可用于呼吸面具中氧气的来源 |
11.在反应KNO2$\stackrel{△}{→}$K2O+NO↑+O2↑(未配平)中,当生成33.6L NO(标准状况)时,被氧化的氧原子的物质的量为( )
| A. | 3 mol | B. | 1.5 mol | C. | 0.75 mol | D. | 0.6 mol |
18.某烧杯中盛有含0.1mol (NH4)Al(SO4)2的溶液,现向其中缓缓加入2mol•L-1 NaOH溶液200mL,使其充分反应,此时烧杯中铝元素的存在形式为( )
| A. | Al3+和Al(OH)3 | B. | Al(OH)3 | C. | AlO2-和Al(OH)3 | D. | AlO2- |
8.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 水和植物油 | B. | 水和葡萄糖 | C. | 水和醋酸 | D. | 水和酒精 |
15.已知热化学方程式:2H2(g)+O2(g)═2H2O(g)△H1═-483.6kJ•mol-1,则对于热化学方程式:2H2O(1)=2H2(g)+O2(g)△H2═QkJ•mol-1.下列关于Q值的判断正确的是( )
| A. | Q=483.6 | B. | Q>483.6 | C. | Q<483.6 | D. | 无法确定 |
12.下列实验能成功的是( )
①用MgCl2溶液鉴别Na2CO3和NaOH溶液
②用稀盐酸鉴别Na2CO3溶液和NaHCO3溶液
③用观察法区别Na2O和Na2O2
④用澄清石灰水鉴别Na2CO3溶液和NaHCO3固体.
①用MgCl2溶液鉴别Na2CO3和NaOH溶液
②用稀盐酸鉴别Na2CO3溶液和NaHCO3溶液
③用观察法区别Na2O和Na2O2
④用澄清石灰水鉴别Na2CO3溶液和NaHCO3固体.
| A. | ①②③④ | B. | ③④ | C. | ②③ | D. | ②③④ |
13.如图为实验室制取氨气的实验装置图.下列说法错误的是( )
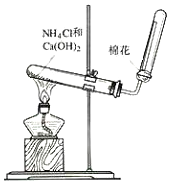

| A. | 收集方法是向下排空气法 | |
| B. | 将湿润的蓝色石蕊试纸放在试管口处验满 | |
| C. | 试管口的棉花可防止氨气与空气形成对流,利于收集氨气 | |
| D. | 实验结束后将蘸有稀硫酸的棉花放在导管口吸收剩余氨气 |