题目内容
11.用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答(1)将称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是BC(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Cl-)+c(Na+)>c(OH-)+c(H+)
(5)根据下列数据计算,c(NaOH)0.40mol/L
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.60 | 20.50 |
| 第二次 | 10.00 | 3.00 | 23.10 |
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面.
分析 (1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来解答;
(2)根据碱性溶液盛放在碱式滴定管中;
(3)根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)滴定过程中溶液从碱性溶液向中性过渡,溶液里的溶质从NaOH到NaCl、NaOH过渡,最后呈中性是溶质为NaCl,但溶液始终显中性,存在电荷守恒式:c(Na+)+c(H+)=c(OH-)+c(Cl-),据此分析判断;
(5)先分析所耗盐酸标准液的体积的有效性,然后求出所耗盐酸标准液的体积平均值,然后根据关系式HCl~NaOH来解答.
(6)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取),冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以试验除了需要250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒;
故答案为:玻璃棒;
(2)烧碱显碱性,故需要用碱式滴定管量取烧碱溶液;
故答案为:碱;
(3)滴定前溶液为红色,滴定终点时溶液为无色,所以滴定终点现象为滴最后一滴溶液由红色变为无色,半分钟不褪色;
故答案为:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色;
(4)A.若c(Na+)>c(Cl-)>c(H+)>c(OH-)成立,则c(Na+)+c(H+)>c(Cl-)+c(OH-),明显与溶液里存在的电荷式c(Na+)+c(H+)=c(OH-)+c(Cl-)不符,故A错误;
B.在NaOH溶液只滴加几滴稀盐酸,此时溶液只生成少量NaCl,应该存在:c(Na+)>c(OH-)>c(Cl-)>c(H+),故B正确;
C.溶液始终显中性,存在电荷守恒式:c(Na+)+c(H+)=c(OH-)+c(Cl-),故C正确;
D.c(Na+)+c(H+)>c(OH-)+c(Cl-)与溶液里存在的电荷式c(Na+)+c(H+)=c(OH-)+c(Cl-)不符,故D错误;
故选BC;
(5)所耗盐酸标准液的体积分别为:19.90mL,20.10mL,两组数据均有效,盐酸标准液的平均体积为20.00mL;
HCl~NaOH
1 1
0.2000mol/L×20.00mL c(NaOH)×10mL
解得:c(NaOH)=0.4mol/L,
故答案为:0.40;
(6)A.滴定前平视,滴定后俯视,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,烧碱纯度偏小,故A错误;
B.未用标准液润洗滴定管,标准液浓度减小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,烧碱纯度偏大,故B正确;
C.用待测液润洗锥形瓶,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,烧碱纯度偏大,故C正确;
D.不小心将标准液滴在锥形瓶外面,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,烧碱纯度偏大,故D正确;
故选BCD.
点评 本题主要考查了酸碱中和滴定实验操作、计算与误差分析以及滴定过程中溶液里离子浓度大小比较,难度不大,能准确写出溶液里的电荷守恒式是解答关键,结合所学知识即可完成.

 阅读快车系列答案
阅读快车系列答案| A. | 二者的pH仍然相等且均为5 | B. | 盐酸的pH大 | ||
| C. | 醋酸的pH大 | D. | 盐酸的pH为5,醋酸的pH在3~5之间 |
(A)移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)BDCEAF.
(2)重复三次的实验数据如下表所示:
| 实验序号 | 消耗0.1032mol•L-1的氢氧化钠溶液的体积/mL | 待测盐酸溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
(3)滴定至终点的现象是溶液由无色变为浅红色,且半分钟内不褪色.
(4)下列操作中可能使所测盐酸的浓度数值偏低的是D.
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和时,该溶液中离子浓度大小关系为
(Cl-)>c(NH4+)>c(H+)>c(OH-).

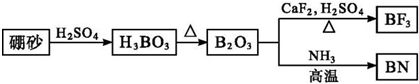
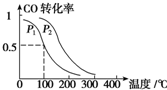 工业上CO 也用于合成甲醇:
工业上CO 也用于合成甲醇: