题目内容
20.有以下说法:①氯原子和氯离子性质一样 ②+7价的氯只具有氧化性 ③氯原子比氯离子多一个电子 ④氯气具有氧化性,不具有还原性 ⑤氯原子比氯离子半径小 ⑥高氯酸是最高价含氧酸中酸性最强的,其中说法正确的是( )| A. | ③⑤⑥ | B. | ①②③ | C. | ②⑤⑥ | D. | ④⑤⑥ |
分析 ①依据元素的化学性质是由原子或离子的最外层电子数决定;
②化合价在最高价具有氧化性、最低价具有还原性,中间价态具有氧化性和还原性;
③依据氯原子最外层电子数是7,氯离子是得电子形成分析;
④根据化合价判断;
⑤氯原子得到一个电子形成氯离子;
⑥元素的非金属性越强,其最高价含氧酸的酸性越强.
解答 解:①氯原子的最外层电子数未达到8个,容易的1个电子形成氯离子,而氯离子最外层达到了8电子,比较稳定,比氯原子稳定的多,氯离子和氯原子的性质不一样,故①错误;
②常见氯元素化合价有+7价、+5价,+1价,0价,-1价,+7价的氯是最高价态,只具有氧化性,故②正确;
③氯离子是氯原子得到一个电子形成的,所以氯离子比氯原子多一个电子,故③错误;
④氯气中Cl元素的化合价为0价,是中间价态,即具有氧化性也具有还原性,故④错误;
⑤氯原子得到一个电子形成氯离子,电子数越多,半径越大,所以氯原子比氯离子半径小,故⑤正确;
⑥元素的非金属性越强,其最高价含氧酸的酸性越强,F没有最高价含氧酸,所以高氯酸是最高价含氧酸中酸性最强,故⑥正确;
综上所述:③④⑤
故选C.
点评 本题考查了氯及其化合物的性质比较,元素和原子的性质区别和联系,物质氧化性的判断,掌握基础知识是解决问题的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.短周期元素W、X、Y、Z的原子序数依次增大,且质子数之和为36.它们可组成离子化合物Y2X和共价化合物ZX3,已知X、Z同主族,下列说法正确的是( )
| A. | 离子半径:Y>Z>X | |
| B. | 阴离子的还原性:W>Z | |
| C. | W和其他3种元素均能形成共价化合物 | |
| D. | X、Y、Z三种元素组成的化合物水溶液一定显碱性 |
11.用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答
(1)将称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是BC(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Cl-)+c(Na+)>c(OH-)+c(H+)
(5)根据下列数据计算,c(NaOH)0.40mol/L
(6)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是BCD
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面.
(1)将称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是BC(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Cl-)+c(Na+)>c(OH-)+c(H+)
(5)根据下列数据计算,c(NaOH)0.40mol/L
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.60 | 20.50 |
| 第二次 | 10.00 | 3.00 | 23.10 |
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面.
8.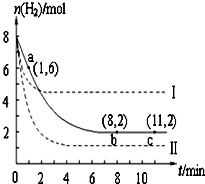 T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
 T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | T℃时,该反应的化学平衡常数为0.125 | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应?△H>0 | |
| C. | 曲线Ⅱ对应的条件改变是降低压强 | |
| D. | 反应开始至a点时v(H2)=1 mol•L-1•min-1 |
15.下列化学用语对应正确的是( )
| A. | NH4Cl的电子式: | B. | 甲烷的结构式: | C. | H2O2的电子式: | D. | CCl4的电子式: |
5.下列说法正确的是( )
| A. | 离子化合物中只能含有离子键 | |
| B. | 共价化合物中可能含有离子键 | |
| C. | 含有离子键的化合物一定属于离子化合物 | |
| D. | 含共价键的化合物一定是共价化合物 |
12.下列变化规律的叙述中,正确的是( )
| A. | F-、Cl-、Br-、I-的还原性逐渐减弱 | B. | NaOH、KOH、RbOH的碱性逐渐减弱 | ||
| C. | Li、Na、K、Rb、Cs的金属性逐渐减弱 | D. | HF、HCl、HBr、HI的稳定性逐渐减弱 |
9.下列有关电解质的说法正确的是( )
| A. | 强电解质的溶液一定比弱电解质的溶液导电性强 | |
| B. | 易溶性强电解质的溶液中不存在溶质分子 | |
| C. | 强电解质都是离子化合物,而弱电解质都是共价化合物 | |
| D. | 由于硫酸钡难溶于水,所以是弱电解质 |
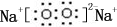 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.