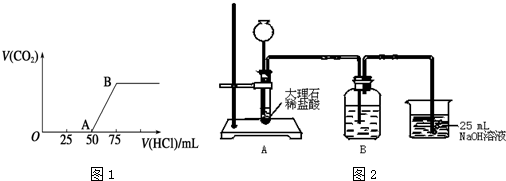
题目内容
19.明矾石经处理后得到明矾[KAl(SO4)2•12H2O].从明矾制备Al、K2SO4和H2SO4的工艺过程如图1所示: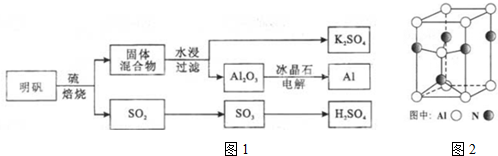
焙烧明矾的化学方程式为:4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是S.
(2)本工艺的产品Al可以与CuO发生铝热反应而得到Cu.金属晶体铜的原子堆积方式是面心立方最密堆积;铜与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+2SO2↑+2H2O.
(3)A12O3在一定条件下可制得AIN,其晶体结构如图2所示,该晶体中Al的配位数是4
(4)将SO2通入氨水与BaCl2的混合溶液中,可产生白色沉淀(不考虑溶液中溶解的氧),写出该反应的总离子方程式是2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+
或2NH3•H2O+SO2+Ba2+=BaSO3↓+2 H2O+2NH4+.
(5)焙烧产生的SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=一197kJ/mol;
H2O (g)=H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol.
则SO3 (g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol.
分析 (1)依据化学方程式中元素化合价变化分析判断,元素化合价升高的做还原剂发生氧化反应;
(2)在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个原子周围都有12个原子与之相连;
(3)配位化合物中直接和中心原子(或离子)相联系的配位原子的数目;
(4)氨水和二氧化硫、氯化钡溶液之间会发生反应得到亚硫酸钡沉淀;
(5)利用盖斯定律,将热化学方程式进行运算,(③-①+②)×$\frac{1}{2}$计算反应的焓变,得到SO3 (g)与H2O(l)反应的热化学方程式.
解答 解;(1)4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价,硫酸根离子中硫元素化合价从+6价变化为+4价,还原剂是硫单质,
故答案为:S;
(2)在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个原子周围都有12个原子与之相连,对于铜原子也是如此,属于面心立方最密堆积,铜与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+2SO2↑+2H2O.
故答案为:面心立方最密堆积;Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+2SO2↑+2H2O;
(3)依据晶体晶胞结构分析,结合配位数含义可知,每个铝原子和四个单原子相连,所以铝原子的配位数为4,
故答案为:4;
(4)氨水和二氧化硫、氯化钡溶液之间会发生反应得到亚硫酸钡沉淀,发生反应为:2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+或2NH3•H2O+SO2+Ba2+=BaSO3↓+2 H2O+2NH4+,故答案为:2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+或2NH3•H2O+SO2+Ba2+=BaSO3↓+2 H2O+2NH4+;
(5)2SO2(g)+O2(g)=2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=-44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①+②)×$\frac{1}{2}$得SO3 (g)+H2O(l)=H2SO4(l)△H=-130kJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol.
点评 本题考查了氧化还原反应概念分析判断,晶体结构的理解分析,原电池反应的实质应用,热化学方程式和盖斯定律的计算,元素守恒的计算应用,题目难度中等.

 名校课堂系列答案
名校课堂系列答案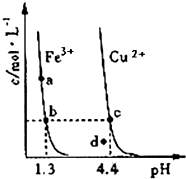 某温度下,将Fe(OH)3(s)、Cu(OH)2(s)分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液pH的变化如图所示.下列判断正确的是( )
某温度下,将Fe(OH)3(s)、Cu(OH)2(s)分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液pH的变化如图所示.下列判断正确的是( )| A. | 该温度下,Ksp[Fe(OH)3]>Ksp[Cu(OH)2] | |
| B. | c、d 两点代表的溶液中c(H+) 与c(OH-) 乘积不相等 | |
| C. | Cu(OH)2在c点比在d点代表的溶液中溶解程度小 | |
| D. | 加适量浓NH3•H2O可使溶液由a点变到b点 |
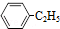 (g)?
(g)?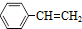 (g)+H2(g)△H=akJ•mol-1,经一段时间后达到平衡,反应过程中测定的部分数据见表:
(g)+H2(g)△H=akJ•mol-1,经一段时间后达到平衡,反应过程中测定的部分数据见表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20min的平均速率为v(H2)=0.008mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol•L-1,则a<0 | |
| C. | 保持其他条件不变,平衡后向容器中再充入0.40mol乙苯,再次达到平衡时乙苯的转化率小于50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 molH2,达到平衡前v(正)>v(逆) |
A.煤炭制氢气,相关反应为:
C(s)+H2O(g)?CO(g)+H2(g),△H=a kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g),△H=b kJ•mol-1
B.氯碱工业中电解饱和食盐水制备氢气.
C.硫铁矿(FeS2)燃烧产生的SO2通过如图碘循环工艺过程制备H2:

回答问题:
(1)某温度(T1)下,向容积为2L的密闭容器中充入一定量的CO和H2O,发生煤炭制氢气的一个反应:反应过程中测定的部分数据如表(表中t1<t2):
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
保持其他条件不变,温度由T1升至T2,上述反应平衡常数为0.64,则正反应为放热(吸热、放热)反应.
保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时,n(CO2)=0.40 mol.
(2)写出方法B制备氢气的离子方程式;2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑
(3)膜反应器常利用膜的特殊功能实现反应产物的选择性分离.方法C在HI分解反应中使用膜反应器分离出H2的目的是减小氢气的浓度,使HI分解平衡正向移动,提高HI的分解率.
(4)反应:C(s)+CO2(g)=2CO(g),△H=(a-b)kJ•mol-1.
(5)某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为:2CO2+4e-+2H2O=2CO+4OH-.
(1)已知:
CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316kJ•mol-1.
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的是提高甲醇的转化率.
(2)工业上可用如下方法合成甲醛,化学方程式为CO(g)+2H2(g)=CH3OH(g),已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |

请回答下列问题:
①如图中曲线a到曲线b的措施是加入催化剂.
②已知CO中的C与O之间为三键,其键能为xkJ/mol,则x=1097.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池正极的电极反应式为O2+2H2O-4e-=4OH-.
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol/L | 0.5 | 2 | 2 | 0.5 |
(4)电解水蒸气和CO2产生合成气(H2+CO),较高温度下(700-1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由右图可知A为直流电源的负极(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:H2O+2e-=H2↑+O2-.
| A. | K | B. | Ca | C. | Na | D. | Fe |