题目内容
在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
请填写下列空白:
(1)该反应方程式可表示为: ;反应达平衡时,A的转化率为 .
(2)从反应开始到达化学平衡,消耗A的平均反应速率为 ;25℃时,反应的化学平衡常数K= .
(3)如果上述反应起始是按“1molA+3molB”充入,达平衡时C的浓度为amol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为amol/L的是 (填序号):
①2mol A+6mol B ②2mol C ③4mol C ④0.5mol A+1.5mol B+1mol C.
| 物质 | A | B | C |
| 初始浓度/mol?L-1 | 1.0 | 2.0 | 0 |
| 2min时,平衡浓度/mol?L-1 | 0.4 | 0.2 | 1.2 |
(1)该反应方程式可表示为:
(2)从反应开始到达化学平衡,消耗A的平均反应速率为
(3)如果上述反应起始是按“1molA+3molB”充入,达平衡时C的浓度为amol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为amol/L的是
①2mol A+6mol B ②2mol C ③4mol C ④0.5mol A+1.5mol B+1mol C.
考点:化学平衡的计算,等效平衡
专题:化学平衡专题
分析:(1)依据图标数据分析计算,物质反应的物质的量之比等于化学方程式计量数之比;转化率=
×100%;
(2)计算平衡反应速率v=
,平衡常数=
;
(3)依据反应特征结合等效平衡分析,“等量等效”的方法分析选项.
| 消耗量 |
| 起始量 |
(2)计算平衡反应速率v=
| △c |
| △t |
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
(3)依据反应特征结合等效平衡分析,“等量等效”的方法分析选项.
解答:
解:(1)依据图表数据ABC的反应浓度分别为:A为1.0mol/L-0.4mol/L=0.6mol/L,B变化的浓度=2.0mol/L-0.2mol/L=1.8mol/L,C的变化浓度=1.2mol/L,反应之比等于化学方程式计量数之比,n(A):n(B):n(C)=0.6:1.8:1.2=1:3:2,反应的化学方程式为A+3B?2C,
A+3B?2C
起始量(mol/L) 1.0 2.0 0
变化量(mol/L) 0.6 1.8 1.2
平衡量(mol/L) 0.4 0.2 1.2
平衡后A的转化率=
×100%=60%,
故答案为:A+3B?2C;60%;
(2)从反应开始到达化学平衡,消耗A的平均反应速率=
=0.3mol/L,平衡常数K=
=450,
故答案为:0.3mol/L;450;
(3)如果上述反应起始是按“1molA+3molB”充入,达平衡时C的浓度为amol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为amol/L,说明反应达到平衡状态相同,反应前后气体物质的量发生变化,所以等量等效,则
A、A+3B?2C
1 3 0
2 6 0
加入2molA,6molB相当于增大压强平衡正向进行,平衡后C的浓度大于2amol/L,故A错误;
B、A+3B?2C
1 3 0
0 0 2
极值转化加入2molC相当于加入1molA,3molB,达到相同的平衡状态,平衡后C的浓度为amol/L,故B正确;
C、A+3B?2C
1 3 0
0 0 4
加入4mol相当于加入2molA,6molB,平衡后C的浓度大于2amol/L,故C错误;
D、A+3B=2C
1 3 0
0.5 1.5 1
1 3 0
极值转化相当于起始量加入1molA和3molB,平衡后C的浓度为amol/L,故D正确;
故选BD.
A+3B?2C
起始量(mol/L) 1.0 2.0 0
变化量(mol/L) 0.6 1.8 1.2
平衡量(mol/L) 0.4 0.2 1.2
平衡后A的转化率=
| 0.6mol/l |
| 1.0mol/L |
故答案为:A+3B?2C;60%;
(2)从反应开始到达化学平衡,消耗A的平均反应速率=
| 0.6mol/L |
| 2min |
| 1.22 |
| 0.4×0.23 |
故答案为:0.3mol/L;450;
(3)如果上述反应起始是按“1molA+3molB”充入,达平衡时C的浓度为amol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为amol/L,说明反应达到平衡状态相同,反应前后气体物质的量发生变化,所以等量等效,则
A、A+3B?2C
1 3 0
2 6 0
加入2molA,6molB相当于增大压强平衡正向进行,平衡后C的浓度大于2amol/L,故A错误;
B、A+3B?2C
1 3 0
0 0 2
极值转化加入2molC相当于加入1molA,3molB,达到相同的平衡状态,平衡后C的浓度为amol/L,故B正确;
C、A+3B?2C
1 3 0
0 0 4
加入4mol相当于加入2molA,6molB,平衡后C的浓度大于2amol/L,故C错误;
D、A+3B=2C
1 3 0
0.5 1.5 1
1 3 0
极值转化相当于起始量加入1molA和3molB,平衡后C的浓度为amol/L,故D正确;
故选BD.
点评:本题考查了化学平衡的计算应用,等效平衡的分析判断,主要是平衡常数、反应速率、平衡浓度的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列物质属于电解质的是( )
①碱石灰 ②熔融NaCl ③石灰水 ④NaOH ⑤液态氧 ⑥KClO3.
①碱石灰 ②熔融NaCl ③石灰水 ④NaOH ⑤液态氧 ⑥KClO3.
| A、①②④⑥ | B、②④⑤⑥ |
| C、②④⑥ | D、①②④⑤⑥ |
取一质量为mg的铜丝在空气中加热后,插入下列液体中,铜丝的质量仍为mg的是( )
| A、盐酸 |
| B、NaOH溶液 |
| C、CH3CHO |
| D、CH3OH |
0.5L的Fe2(SO4)3溶液中Fe3+的浓度为0.2mol/L,与0.2L0.5mol/L的Na2SO4溶液中SO42-的浓度之比是( )
| A、3:2 | B、2:5 |
| C、3:5 | D、5:3 |
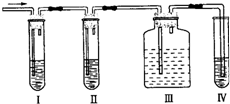 某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题:
某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题: