题目内容
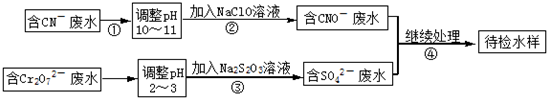
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如图所示的废水处理流程.
回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e:f的值为 (填选项标号).
A.1 B.
C.2 D.不能确定
②若d=e=1,则b= .
若反应中转移0.6mol电子,则生成的气体在标况下的体积是 .
(2)步骤③中反应时,每0.4molCr2O72-转移2.4mol的电子,该反应的离子方程式为
(3)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少. 请用离子方程式表示出现上述颜色变化的原因.
①产生蓝色沉淀的离子方程式为 ,②后又变黑色沉淀的离子方程式为 .
(4)铜是与人类关系非常密切的有色金属,已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生;2Cu+=Cu+Cu2+.大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等.
①写出CuH在过量稀盐酸中有气体生成的离子方程式 .
②将CuH溶解在适量的稀硝酸中,完成下列反应的化学方程式:
CuH+ HNO3-- Cu(NO3)2+ H2↑+ + .

回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e:f的值为
A.1 B.
| 1 |
| 2 |
②若d=e=1,则b=
若反应中转移0.6mol电子,则生成的气体在标况下的体积是
(2)步骤③中反应时,每0.4molCr2O72-转移2.4mol的电子,该反应的离子方程式为
(3)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少. 请用离子方程式表示出现上述颜色变化的原因.
①产生蓝色沉淀的离子方程式为
(4)铜是与人类关系非常密切的有色金属,已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生;2Cu+=Cu+Cu2+.大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等.
①写出CuH在过量稀盐酸中有气体生成的离子方程式
②将CuH溶解在适量的稀硝酸中,完成下列反应的化学方程式:
考点:氧化还原反应方程式的配平,氯、溴、碘及其化合物的综合应用,铜金属及其重要化合物的主要性质
专题:氧化还原反应专题,元素及其化合物
分析:(1)①由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2;
②若d=e=1,根据碳与氮原子之比为1:1,f=2,根据得失电子守恒解答; ③每生成1mol氮气转移12mol电子,据此求解转移0.6mol电子生成的气体体积;
(2)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(3)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析;
(4)①CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,产生的气体为氢气,在酸性溶液中2Cu+=Cu2++Cu;
②Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,能把铜氧化为硝酸铜,CuH具有还原性,因此二者反应生成氢气、一氧化氮气体、铜离子、H2O.
②若d=e=1,根据碳与氮原子之比为1:1,f=2,根据得失电子守恒解答; ③每生成1mol氮气转移12mol电子,据此求解转移0.6mol电子生成的气体体积;
(2)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(3)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析;
(4)①CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,产生的气体为氢气,在酸性溶液中2Cu+=Cu2++Cu;
②Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,能把铜氧化为硝酸铜,CuH具有还原性,因此二者反应生成氢气、一氧化氮气体、铜离子、H2O.
解答:
解:(1)①由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,以因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2,所以e:f=1:2,
故选B;
②反应aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,若d=e=1,根据碳与氮原子之比为1:1,则f=2,由碳元素化合价升高1×2+2×2=6,氮元素化合价升高2×3=6,氯元素化合价降低为6,根据得失电子守恒得到b×2=12,b=6,每生成1mol氮气转移12mol电子,若反应中转移0.6mol电子,则生成0.05mol氮气,则生成的气体在标况下的体积是V=n×Vm=0.05mol×22.4L/mol=1.12L,
故答案为:6;1.12L;
(2)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(3)①待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓产生蓝色沉淀,
故答案为:Cu2++2OH-=Cu(OH)2↓;
②再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),又变黑色沉淀,
故答案为:Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq);
(4)①CuH溶解在稀盐酸中,CuH中的H-失电子盐酸中H+得电子,产生的气体为氢气,酸性溶液中2Cu+=Cu2++Cu,故离子方程式为:2CuH+2H+=Cu2++Cu+2H2↑,
故答案为:2CuH+2H+=Cu2++Cu+2H2↑;
②Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,能把铜氧化为硝酸铜,CuH具有还原性,因此二者反应生成氢气、一氧化氮气体、铜离子、H2O,其化学方程式为:6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O,
故答案为:6;16;6;3;4;NO;8;H2O.
故选B;
②反应aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,若d=e=1,根据碳与氮原子之比为1:1,则f=2,由碳元素化合价升高1×2+2×2=6,氮元素化合价升高2×3=6,氯元素化合价降低为6,根据得失电子守恒得到b×2=12,b=6,每生成1mol氮气转移12mol电子,若反应中转移0.6mol电子,则生成0.05mol氮气,则生成的气体在标况下的体积是V=n×Vm=0.05mol×22.4L/mol=1.12L,
故答案为:6;1.12L;
(2)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(3)①待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓产生蓝色沉淀,
故答案为:Cu2++2OH-=Cu(OH)2↓;
②再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),又变黑色沉淀,
故答案为:Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq);
(4)①CuH溶解在稀盐酸中,CuH中的H-失电子盐酸中H+得电子,产生的气体为氢气,酸性溶液中2Cu+=Cu2++Cu,故离子方程式为:2CuH+2H+=Cu2++Cu+2H2↑,
故答案为:2CuH+2H+=Cu2++Cu+2H2↑;
②Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,能把铜氧化为硝酸铜,CuH具有还原性,因此二者反应生成氢气、一氧化氮气体、铜离子、H2O,其化学方程式为:6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O,
故答案为:6;16;6;3;4;NO;8;H2O.
点评:本题是一道注重了化学与实际生产的联系的综合知识题,考查利用氧化还原反应来实现废水的转化,涉及实验操作,氧化还原反应等,明确该反应中的生成物是解本题关键,结合原子守恒、转移电子守恒来分析解答,题目难度中等.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
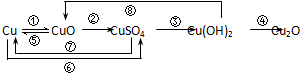
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 物质 编号 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① |  | Cu | CuO | CuSO4 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(NO3)2 |
| A、①②③④ | B、①②③ |
| C、①③④ | D、②④ |
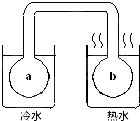 如图所示,密封双球体系中充有红棕色气体X.将左右烧杯中水浴造成温差后,发现a中气体颜色比b中气体的颜色深(不考虑气体液化),则X可能是( )
如图所示,密封双球体系中充有红棕色气体X.将左右烧杯中水浴造成温差后,发现a中气体颜色比b中气体的颜色深(不考虑气体液化),则X可能是( )| A、NO2(g) |
| B、Br2(g) |
| C、NO(g) |
| D、N2(g) |
在给定条件下,下列加点的物质在化学反应中完全消耗的是( )
A、用50 mL 12 mol/L的
| ||||||
B、常温下,将1 g
| ||||||
C、向100 mL 3 mol/L的稀硝酸中加入5.6 g
| ||||||
D、常温常压下,0.1 mol
|
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、在标准状况下,11.2L 氦气含有NA个氦原子 |
| B、25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
| C、11.2L CO含有的分子数为0.5NA |
| D、1mol氧分子含有的电子数与1mol氮气含有的电子数之比为16:7 |
将等质量的铜片在酒精灯上加热后,分别加入下列溶液中,放置片刻,最终铜片质量增加的是( )
| A、硝酸 | B、无水乙醇 |
| C、氢氧化钠溶液 | D、盐酸 |
某粒子含有6个电子、7个中子,呈电中性,则它的化学符号可能是( )
| A、13Al |
| B、13Al |
| C、13C |
| D、13C |
下列关于σ键和π键的理解不正确的是( )
| A、σ键能单独形成,而π键一定不能单独形成 |
| B、σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C、HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的 |
| D、气体单质中一定存在σ键,可能存在π键 |