题目内容
将等质量的铜片在酒精灯上加热后,分别加入下列溶液中,放置片刻,最终铜片质量增加的是( )
| A、硝酸 | B、无水乙醇 |
| C、氢氧化钠溶液 | D、盐酸 |
考点:铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:先根据铜片在酒精灯上加热生成CuO,质量增加,然后考虑表面的氧化铜与选项中的物质是否反应,确定铜片质量如何变化.
解答:
解:A、因铜片在酒精灯上加热后生成CuO,质量增加,将它投入硝酸中,发生反应:CuO+2HNO3═Cu(NO3)2+H2O,Cu2+进入溶液,铜片的质量会减小,故A错误;
B、因铜片在酒精灯上加热后生成CuO,质量增加,将它投入无水乙醇中,发生反应:CH3CH2OH+CuO-→CH3CHO+H2O+Cu,又恢复为铜,铜片的质量不变,故B错误;
C、因铜片在酒精灯上加热后生成CuO,质量增加,将它投入氢氧化钠溶液,氧化铜不与氢氧化钠反应,铜片质量增加,故C正确;
D、因铜片在酒精灯上加热后生成CuO,质量增加,将它投入硝酸中,发生反应:CuO+2HCl═CuCl2+H2O,Cu2+进入溶液,铜片的质量会减小,故D错误;
故选C.
B、因铜片在酒精灯上加热后生成CuO,质量增加,将它投入无水乙醇中,发生反应:CH3CH2OH+CuO-→CH3CHO+H2O+Cu,又恢复为铜,铜片的质量不变,故B错误;
C、因铜片在酒精灯上加热后生成CuO,质量增加,将它投入氢氧化钠溶液,氧化铜不与氢氧化钠反应,铜片质量增加,故C正确;
D、因铜片在酒精灯上加热后生成CuO,质量增加,将它投入硝酸中,发生反应:CuO+2HCl═CuCl2+H2O,Cu2+进入溶液,铜片的质量会减小,故D错误;
故选C.
点评:本题考查铜的性质,在乙醇的催化氧化中,铜的作用是催化剂,质量不变.

练习册系列答案
相关题目
关于居室内空气污染的说法错误的是( )
| A、居室内空气中存在的污染物主要来自于装修材料、日用化学品、香烟烟雾以及家用燃料的燃烧产物等 |
| B、燃料不完全燃烧产生的一氧化碳也是一种室内污染物 |
| C、在居室内放置几盒花草就可消除室内空气污染 |
| D、预防装修污染,最重要的是选择经过严格检测的、环保的装修材料 |
某混合溶液中所含离子的浓度如下表,则M离子可能为( )
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol?L-1) | 2 | 1 | 2 | 1 |
| A、Mg2+ |
| B、Ba2+ |
| C、Na+ |
| D、S2- |


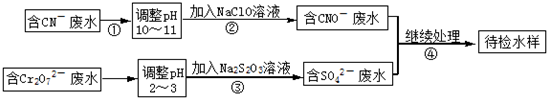
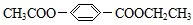 如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题:
如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题: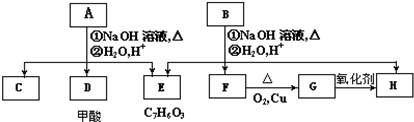
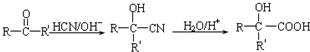
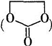 能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式
能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式