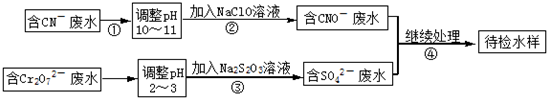
题目内容
铜及其化合物能够发生如下8种转化关系.请结合这8种转化关系回答下列问题: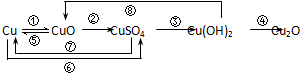
(1)写出一个既是离子反应又是置换反应的离子反应方程式 .
(2)用浓H2SO4实现转化⑥,会产生有毒气体.若使用稀H2SO4和双氧水,在常温下就可实现该转化且无气体产生,该反应的化学方程式为: .
(3)转化④常用于验证醛基的还原性,写出相应的化学方程式: .

(1)写出一个既是离子反应又是置换反应的离子反应方程式
(2)用浓H2SO4实现转化⑥,会产生有毒气体.若使用稀H2SO4和双氧水,在常温下就可实现该转化且无气体产生,该反应的化学方程式为:
(3)转化④常用于验证醛基的还原性,写出相应的化学方程式:
考点:铜金属及其重要化合物的主要性质
专题:几种重要的金属及其化合物
分析:铜与氧气化合生成氧化铜,氧化铜与硫酸发生复分解反应生成硫酸铜,硫酸铜与氢氧化钠发生复分解反应生成氢氧化铜,氢氧化铜发生还原反应生成氧化亚铜,另铜与浓硫酸反应生成硫酸铜,硫酸铜被活泼金属还原为铜,据此分析解答即可.
解答:
解:(1)活泼金属铁可以与硫酸铜反应生成铜单质,属于置换反应,离子方程式写为:Cu2++Fe=Cu+Fe2+,故答案为:Cu2++Fe=Cu+Fe2+;
(2)铜单质具有还原性,双氧水具有强氧化性,故方程式可以写为:Cu+H2O2+H2SO4=CuSO4+2H2O,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O
(3)为了验证醛基的还原性,常用反应2Cu(OH)2+CH3CHO
CH3COOH+Cu2O↓+2H2O来验证,故答案为:2Cu(OH)2+CH3CHO
CH3COOH+Cu2O↓+2H2O.
(2)铜单质具有还原性,双氧水具有强氧化性,故方程式可以写为:Cu+H2O2+H2SO4=CuSO4+2H2O,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O
(3)为了验证醛基的还原性,常用反应2Cu(OH)2+CH3CHO
| △ |
| △ |
点评:本题主要考查的是铜以及其化合物之间的反应、化学反应类型的判断、离子反应方程式的书写,综合性较强.

练习册系列答案
相关题目
在下列物质中,化合物类型相同的一组是( )
| A、NaCl HCl |
| B、CO2 H2O |
| C、H2CO3 KCl |
| D、MgCl2 SO2 |
下列说法中正确的是( )
| A、常温下,反应4Fe(OH)2(s)+2H2O(1)+O2(g)=4Fe(OH)3(s)能自发进行,则该反应的△H<0 |
| B、浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸 |
| C、铅蓄电池在放电过程中,负极质量减少,正极质量增加 |
| D、用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3,说明Ksp(BaSO4)>Ksp(BaCO3) |
铜易生锈,铜合金更易生锈,铜器上往往覆盖着一层铜绿,铜绿的主要成分是( )
| A、CuO |
| B、Cu(OH)2 |
| C、Cu2O |
| D、Cu2(OH)2CO3 |
某混合溶液中所含离子的浓度如下表,则M离子可能为( )
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol?L-1) | 2 | 1 | 2 | 1 |
| A、Mg2+ |
| B、Ba2+ |
| C、Na+ |
| D、S2- |