题目内容
17.关于反应Al2O3+N2+3C═2AlN+3CO,下列说法错误的是( )| A. | AlN是氧化产物,其中N是+3价 | B. | 氧化剂是N2,还原剂是C | ||
| C. | Al2O3既不是氧化剂,也不是还原剂 | D. | 每生成2mol AlN,有6mol电子转移 |
分析 Al2O3+N2+3C=2AlN+3CO中,N元素的化合价降低,C元素的化合价升高,以此来解答.
解答 解:A.反应中N元素化合价由0价降低到-3价,被还原,则AlN为还原产物,故A错误;
B.反应中N元素化合价降低,C元素化合价升高,则氧化剂是N2,还原剂是C,故B正确;
C.反应中Al、O元素化合价不发生变化,则Al2O3既不是氧化剂,也不是还原剂,故C正确;
D.反应中N元素化合价由0价降低到-3价,则每生成2mol AlN,有6mol电子转移,故D正确.
故选A.
点评 本题考查氧化还原反应,侧重氧化还原基本概念的考查,把握反应中元素的化合价变化为解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.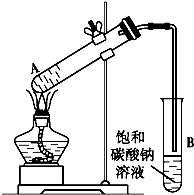 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.
有关数据及副反应:
(1)在大试管A中添加的试剂有6 mL乙醇、4 mL乙酸和4 mL浓硫酸,这三种试剂的添加顺序依次为乙醇、浓硫酸、乙酸.
(2)试管B中导管接近液面未伸入液面下的理由是防止倒吸.
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是除去乙酸乙酯中的水.
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生酸性废水,污染环境,同时发生副反应.
(5)炒菜时,加一点白酒和醋能使菜肴味香可口,试用符合实际情况的化学方程式解释:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.有关数据及副反应:
| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5(乙醚) | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
(2)试管B中导管接近液面未伸入液面下的理由是防止倒吸.
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是除去乙酸乙酯中的水.
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生酸性废水,污染环境,同时发生副反应.
(5)炒菜时,加一点白酒和醋能使菜肴味香可口,试用符合实际情况的化学方程式解释:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
8.将物质的量均为0.1mol AlCl3、K2SO4和Al2(SO4)3溶于水,向其中加入一定量的Ba(OH)2溶液,测得溶液与沉淀中均含有铝元素,则生成BaSO4的物质的量不可能为( )
| A. | 0.2mol | B. | 0.25 mol | C. | 0.35 mol | D. | 0.45 mol |
12.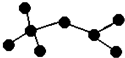 如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
(1)用系统命名法命名2,2,4-三甲基戊烷.
(2)M的一氯代物有4种.
(3)含有一个甲基和一个乙基的M的同分异构体有2种.
 如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:(1)用系统命名法命名2,2,4-三甲基戊烷.
(2)M的一氯代物有4种.
(3)含有一个甲基和一个乙基的M的同分异构体有2种.
2.下列各组中两种气体所含的原子数一定相等的是( )
| A. | 温度相同,体积相同的O2和N2 | |
| B. | 质量相等,密度不等的N2和CO | |
| C. | 体积相等,密度相等的CO和C2H4 (C2H4 为乙烯气体) | |
| D. | 压强相同、体积相同的N2和O2 |
6.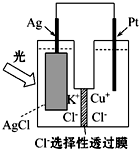 一种光化学电池的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学电池的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
 一种光化学电池的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学电池的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )| A. | 生成108 g银,转移电子个数为1 mol | |
| B. | Cu+在负极发生氧化反应 | |
| C. | Ag电极活泼,Ag失电子发生氧化反应 | |
| D. | Cl-由负极迁移到正极 |
7.有机化合物与无机化合物在结构和性质上没有截然不同的区别.十九世纪中叶,科学家们用一系列实验证明了这一点.其中最著名的实验是1828年德国青年化学家维勒(Wohler)在蒸发氰酸铵溶液(NH4CNO)时得到了一种有机物,该有机物是( )
| A. | 乙酸(CH3COOH) | B. | 氨基乙酸(H2N-CH2-COOH) | ||
| C. | 尿素(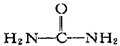 ) ) | D. | 硝化甘油(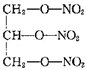 ) ) |
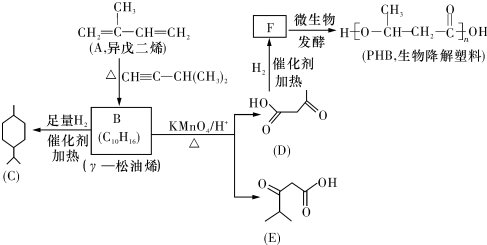
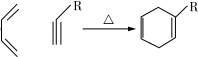
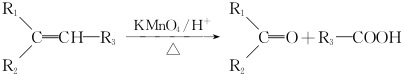
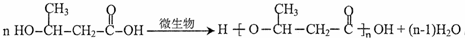 .
.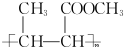 (一种类似有机玻璃的塑料).在催化剂作用下,第三步反应的化学方程式是
(一种类似有机玻璃的塑料).在催化剂作用下,第三步反应的化学方程式是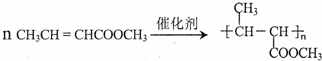 .
.