题目内容
10.在反应C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O中,氧化剂是( )| A. | C | B. | HNO3 | C. | CO2 | D. | SO2 |
分析 在反应中,N元素化合价由+5价变为+4,得电子化合价降低的反应物是氧化剂,据此分析解答.
解答 解:在反应C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O中,N元素化合价由+5价变为+4,得电子化合价降低的反应物是氧化剂,则HNO3是氧化剂,
故选B.
点评 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,结合基本概念分析,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列性质中,不能说明乙酸是弱电解质的是( )
| A. | 醋酸钠溶液的PH 大于7 | |
| B. | 常温时,0.1mol/L乙酸溶液的PH约为3 | |
| C. | 乙酸能和碳酸钙反应放出CO2 | |
| D. | PH=1的醋酸溶液用水稀释1000倍后,pH<4 |
18.已知在298K时,2g氢气与氧气完全反应生成液态水放热285.8kJ,则此反应的热化学方程式为( )
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 |
5.下列说法不正确的是( )
| A. | 电解法制铝工艺的发明使铝在生产生活中得以迅速普及 | |
| B. | 合成氨工艺的开发缓解了人类有限耕地资源与庞大粮食需求的矛盾 | |
| C. | 研究影响化学反应速率的因素对提高可逆反应的限度具有决定性作用 | |
| D. | 燃料电池的能量转换效率高具有广阔的前景 |
15.下列仪器对应的名称正确的是( )
| A. | 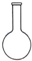 容量瓶 | B. |  萃取瓶 | C. | 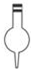 锥形瓶 | D. |  酸式滴定管 |
2.已知反应:C(s)+CO2(g)?2CO(g)△H>0一定条件下,改变某一个反应条件一定能使反应速率显著加快的是( )
| A. | 降低反应体系的压强 | B. | 增加反应物碳的用量 | ||
| C. | 缩小反应体系的体积 | D. | 减少体系中CO的量 |
19.某温度下,0.200mol•L-1的HA溶液与0.200mol•L-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是( )
| 微粒 | X | Y | Na+ | A- |
| 浓度/(mol•L-1) | 8.00×10-4 | 2.50×10-10 | 0.100 | 9.92×10-2 |
| A. | 0.1mol•L-1HA溶液的pH=1 | B. | 该温度下Kw=1.0×10-14 | ||
| C. | 微粒X表示OH-,Y表示H+ | D. | 混合溶液中:n(A-)+n(X)=n(Na+) |
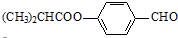 .合成M的一种途径如下
.合成M的一种途径如下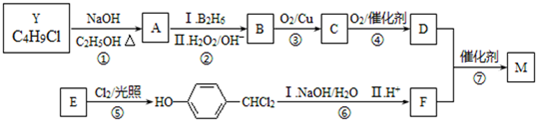
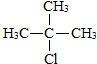 .
.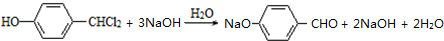 .
. .
.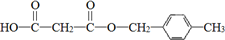 .
.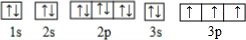 .
.