题目内容
有Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的某几种组成的混合物,向混合物中加入足量的盐酸有气体放出,将放出的气体通过过量的NaOH溶液后,气体体积有所减少,若将上述混合物在空气中充分加热,也有气体放出,且加热后残留固体物质的质量比加热前增加,下列推断正确的是( )
| A、混合物中一定不含有Na2O |
| B、混合物中一定不含有Na2CO3和NaCl |
| C、混合物中肯定含Na2O2、Na2O2和NaHCO3 |
| D、混合物中一定不含有Na2O2和NaCl |
考点:钠的重要化合物
专题:元素及其化合物
分析:盐酸可以和过氧化钠反应产生氧气,和碳酸钠、碳酸氢钠反应可以释放出二氧化碳,二氧化碳可以和氢氧化钠反应,氧气不反应,碳酸氢钠受热分解会生成二氧化碳气体,过氧化钠和二氧化碳反应是固体质量增加的反应.
解答:
解:向混合物中加入足量的盐酸,有气体放出,该气体可以是氧气或者是二氧化碳中的至少一种,将放出的气体通过过量的NaOH溶液后,气体体积有所减少,说明气体是氧气和二氧化碳的混合物,物质中一定含有过氧化钠,含有碳酸钠、碳酸氢钠中的至少一种,将上述混合物在空气中充分加热,也有气体放出,且加热后残留固体物质的质量比加热前有所增加,则可能的混合物组合有:①Na2O2、NaHCO3(NaCl、Na2CO3),②Na2O、Na2O2、NaHCO3(NaCl),括号里的物品存在与否并不影响实验,所以混合物组合有多种.
故选C.
故选C.
点评:本题考查学生金属钠的化合物的性质知识,可以根据教材知识来回答,综合性较强,难度较大.

练习册系列答案
相关题目
将过量的二氧化碳通入下列溶液中,最终会出现浑浊的是( )
| A、氯化钙溶液 | B、澄清的石灰水 |
| C、水玻璃 | D、硝酸钡溶液 |

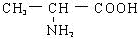 ⑥Al这六种物质中,既能与强酸溶液(如HCl),又能与强碱溶液(如NaOH)反应的有
⑥Al这六种物质中,既能与强酸溶液(如HCl),又能与强碱溶液(如NaOH)反应的有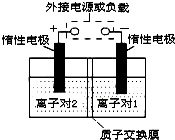 全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.
全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.