题目内容
下列热化学方程式正确的是(△H的绝对值均正确)( )
| A、2NO2?N2O4△H=-57kJ/mol(反应热) | ||
B、
| ||
| C、S(s)+O2(g)═SO2(g)△H=+269.8kJ/mol(反应热) | ||
D、C8H18(l)+
|
考点:热化学方程式
专题:化学反应中的能量变化
分析:A、热化学方程式是标注物质聚集状态和反应放出或吸收的热量.
B、中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
C、热化学方程式应标注物质聚集状态,反应放热,反应热为负值,反应吸热,反应热为正值;
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量.
B、中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
C、热化学方程式应标注物质聚集状态,反应放热,反应热为负值,反应吸热,反应热为正值;
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量.
解答:
解:A、2NO2?N2O4△H=-57kJ/mol(反应热),未标注物质聚集状态,故A错误;
B、
Ba(OH)2(aq)+HCl(aq)═1/2BaCl2(aq)+H2O(l)△H=-57.3kJ/mol(中和热),符合中和热概念,故B正确;
C、S(s)+O2(g)═SO2(g)△H=+269.8kJ/mol(反应热),物质的燃烧应为放热反应,△H应为负值,故C错误;
D、C8H18(l)+
O2(g)═8CO2(g)+9H2O(g)△H=-5518kJ?mol-1(燃烧热)反应中生成 的氧化物水是气体,不是稳定氧化物,故D错误;
故选B.
B、
| 1 |
| 2 |
C、S(s)+O2(g)═SO2(g)△H=+269.8kJ/mol(反应热),物质的燃烧应为放热反应,△H应为负值,故C错误;
D、C8H18(l)+
| 1 |
| 2 |
故选B.
点评:本题考查了燃烧热、中和热、热化学方程式的书写方法和判断,关键是概念的理解,题目较简单.

练习册系列答案
相关题目
下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是( )
| A、碘水 | B、溴水 |
| C、氯水 | D、NaOH溶液 |
将过氧化钠和过量的碳酸氢钠在密闭容器中混合充分加热后,最终残留固体物质是( )
| A、Na2CO3 |
| B、Na2O和Na2O2 |
| C、Na2O2 |
| D、Na2O2和Na2CO3 |
有A、B、C、D四种非金属元素:A、B在反应中各结合1个电子,形成稳定的结构,且B-的还原性小于A-的还原性;氢化物稳定性HD<HA;原子序数C<D,且C、D的稳定结构的核外电子数相等.则这四种元素非金属金属由强到弱的排列顺序是( )
| A、A、B、C、D |
| B、B、A、C、D |
| C、A、B、D、C |
| D、B、A、D、C |
可溶性化合物A、B、C由下表中离子组合而成(每种离子只存在于一种化合物中).
现将等物质的量的A、B、C一起溶于水后,所得混合溶液中除H+、OH-外还含有五离子.则A的化学式不可能是( )
| 阳离子 | Mg2+、Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
| A、AgNO3 |
| B、Na2SO4 |
| C、MgCl2 |
| D、MgSO4 |
对于同位素的概念,下列叙述中正确的是( )
| A、原子序数相等,化学性质与质量数不同 |
| B、原子序数相等,并有相同的化学性质和相同的质量数 |
| C、原子序数相等,化学性质几乎完全相同,而中子数不同 |
| D、化学性质相同,而质量数与原子序数不同 |


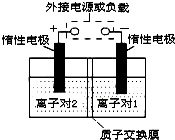 全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.
全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.