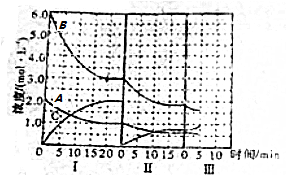
题目内容
17.周期表前20号中的五种常见元素A、B、C、D、E原子序数依次减小,其中A是前20号元素中最活泼的金属元素,且A、B、C 三种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应,D的气态氢化物能被其最高价氧化物对应水化物吸收生成盐,E元素原子最外层电子数是次外层电子数的2倍.(1)写出下列元素名称:
A钾,B硫,C铝,D氮,E碳
(2)写出A、B、C 三种元素的最高价氧化物对应水化物两两之间发生反应的化学方程式:
①Al(OH)3+KOH═KAlO2+2H2O;②2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O.
(3)比较D、E的最高价氧化物的水化物的酸性:HNO3>H2CO3(用化学式及”<”或”>”表示)
分析 周期表前20号中的五种常见元素A、B、C、D、E原子序数依次减小,其中A是前20号元素中最活泼的金属元素,则A为K元素;且A、B、C 三种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应,则C为Al元素,B元素的最外层电子数为10-3-1=6,所以C为S元素;D的气态氢化物能被其最高价氧化物对应水化物吸收生成盐,所以D为N元素;E元素原子最外层电子数是次外层电子数的2倍,E有两个电子层,K层有2个电子,L层有4个电子,则电子总数为6,即E为C元素;结合元素化合物知识来解答.
解答 解:周期表前20号中的五种常见元素A、B、C、D、E原子序数依次减小,其中A是前20号元素中最活泼的金属元素,则A为K元素;且A、B、C 三种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应,则C为Al元素,B元素的最外层电子数为10-3-1=6,所以C为S元素;D的气态氢化物能被其最高价氧化物对应水化物吸收生成盐,所以D为N元素;E元素原子最外层电子数是次外层电子数的2倍,E有两个电子层,K层有2个电子,L层有4个电子,则电子总数为6,即E为C元素;
(1)由分析可知,各元素名称为:A为钾;B为硫;C为铝;D为氮;E为碳;
故答案为:钾,硫,铝,氮,碳;
(2)A、B、C 三种元素的最高价氧化物对应水化物分别为KOH、H2SO4、Al(OH)3,Al(OH)3与KOH反应生成偏铝酸钾和水,反应方程式为:Al(OH)3+KOH═KAlO2+2H2O;H2SO4与Al(OH)3反应生成硫酸铝和水,反应方程式为:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O;
故答案为:Al(OH)3+KOH═KAlO2+2H2O;2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O;
(3)元素的非金属性越强,其最高价氧化物的水化物的酸性越强,非金属性:N>C,则酸性:HNO3>H2CO3;
故答案为:HNO3>H2CO3.
点评 本题考查位置、结构及性质的应用,把握元素在周期表的位置、元素化合物知识为解答的关键,注意电子排布的应用及氢氧化铝的两性,侧重分析与推断能力的考查,题目难度不大.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 已知NH4F水溶液中含有HF分子,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 |
| A. | S(g)+O2(g)=SO2(g)放出热量大于297.23kJ | |
| B. | S(g)+O2(g)=SO2(g)放出热量小于297.23kJ | |
| C. | △H=-297.23kJ•mol-1表示固体S的燃烧热 | |
| D. | 形成1molSO2化学键释放的总能量大于断裂1molS(s)和1molO2(g)化学键吸收的总能量 |
| A. | ${\;}_{53}^{127}$I与${\;}_{53}^{129}$I互为同位素 | |
| B. | Na+的结构示意图为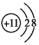 | |
| C. | 高氯酸(HClO4)中氯元素的化合价为+7 | |
| D. | I和Cl是同一主族元素,HI比HCl稳定 |
| A. | 氯原子的结构示意图为  | |
| B. | 质量数为37的氯原子${\;}_{17}^{37}$Cl | |
| C. | 氯化镁的电子式:Mg2+[Cl]2 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
| A. | 中和反应是吸热反应 | |
| B. | 需要加热的反应都是吸热反应 | |
| C. | 断裂化学键要吸收能量 | |
| D. | 反应物总能量一定等于生成物总能量 |
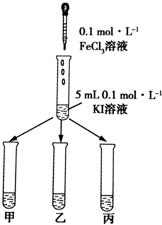 某学习小组通过下面的实验一和实验二,探究某些化学理论.
某学习小组通过下面的实验一和实验二,探究某些化学理论.实验一:以反应2Fe3++2I-=2Fe2++I2为例,
探究该反应是否为可逆反应.
实验方法:在KI溶液中滴加3mlFeCl3溶液,将混合液均
匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉
溶液,往试管乙中滴加KSCN溶液.如图所示:
(1)若试管甲中出现变蓝现象;
乙试管中出现血红色现象,
则说明该反应为可逆反应.
实验二:实验室制备CO2的反应.实验过程中的数据及相关信息如下表:
| 序号 | 反应温度/℃ | C(HCl)/mol•L-1 | V(HCl)/ml | 10g碳酸钙的形状 | t/min |
| ① | 20 | 2 | 10 | 块状 | t 1 |
| ② | 20 | 4 | 10 | 块状 | t 2 |
| ③ | 20 | 2 | 10 | 粉末 | t 3 |
| ④ | 40 | 2 | 10 | 粉末 | t 4 |
| ⑤ | 40 | 4 | 10 | 粉末 | t5 |
(2)由表格中的信息可知实验二的目的是探究影响化学反应速率的因素
(3)实验①和实验②是探究浓度对该化学反应速率的影响,分析表格中的信息可知,对该化学反应速率的影响因素还有温度、接触面积
(4)收集a ml CO2所需的时间最少的实验是⑤(填实验序号)