题目内容
19.(1)现有0.01mol•L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是:第一步,把小块pH试纸放在表面皿(或玻璃片)上;
第二步,用玻璃棒蘸取待测液滴在PH试纸上,然后与标准比色卡对比
(2)该纯碱溶液呈碱性的原因(用离子方程式表示)是CO32-+H2O?HCO3-+OH-,你认为该溶液pH的范围一定介于7至12之间.
分析 (1)用pH试纸测定的具体测定方法是用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;
(2)根据盐的类型分析;根据水解程度分析.
解答 解:(1)用pH试纸测定的具体测定方法是用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH,故答案为:用玻璃棒蘸取待测液滴在PH试纸上,然后与标准比色卡对比;
(2)纯碱是强碱弱酸盐,碳酸根离子能发生水解使溶液中的氢氧根离子的浓度大于氢离子的浓度,导致溶液呈碱性,离子方程式为 CO32-+H2O?HCO3-+OH-;在25℃时,因为溶液呈碱性,所以pH值大于7,虽然碳酸钠能水解,假设碳酸根离子全部水解,溶液中氢氧根离子的浓度为0.01mol/L,PH值=12,但水解是微弱的,不能使碳酸根离子全部水解,所以pH值小于12,故答案为:CO32-+H2O?HCO3-+OH-;12.
点评 本题考察了实验基本操作、pH试纸的正确使用方法、盐类水解的应用,题目难度中等.

练习册系列答案
相关题目
9.下列化学用语的书写正确的是( )
| A. | 氯原子的结构示意图为  | |
| B. | 质量数为37的氯原子${\;}_{17}^{37}$Cl | |
| C. | 氯化镁的电子式:Mg2+[Cl]2 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
7.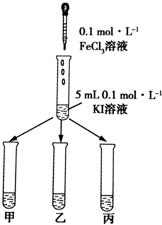 某学习小组通过下面的实验一和实验二,探究某些化学理论.
某学习小组通过下面的实验一和实验二,探究某些化学理论.
实验一:以反应2Fe3++2I-=2Fe2++I2为例,
探究该反应是否为可逆反应.
实验方法:在KI溶液中滴加3mlFeCl3溶液,将混合液均
匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉
溶液,往试管乙中滴加KSCN溶液.如图所示:
(1)若试管甲中出现变蓝现象;
乙试管中出现血红色现象,
则说明该反应为可逆反应.
实验二:实验室制备CO2的反应.实验过程中的数据及相关信息如下表:
※t表示收集相同状况下体积都为a ml CO2所需的时间※
(2)由表格中的信息可知实验二的目的是探究影响化学反应速率的因素
(3)实验①和实验②是探究浓度对该化学反应速率的影响,分析表格中的信息可知,对该化学反应速率的影响因素还有温度、接触面积
(4)收集a ml CO2所需的时间最少的实验是⑤(填实验序号)
 某学习小组通过下面的实验一和实验二,探究某些化学理论.
某学习小组通过下面的实验一和实验二,探究某些化学理论.实验一:以反应2Fe3++2I-=2Fe2++I2为例,
探究该反应是否为可逆反应.
实验方法:在KI溶液中滴加3mlFeCl3溶液,将混合液均
匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉
溶液,往试管乙中滴加KSCN溶液.如图所示:
(1)若试管甲中出现变蓝现象;
乙试管中出现血红色现象,
则说明该反应为可逆反应.
实验二:实验室制备CO2的反应.实验过程中的数据及相关信息如下表:
| 序号 | 反应温度/℃ | C(HCl)/mol•L-1 | V(HCl)/ml | 10g碳酸钙的形状 | t/min |
| ① | 20 | 2 | 10 | 块状 | t 1 |
| ② | 20 | 4 | 10 | 块状 | t 2 |
| ③ | 20 | 2 | 10 | 粉末 | t 3 |
| ④ | 40 | 2 | 10 | 粉末 | t 4 |
| ⑤ | 40 | 4 | 10 | 粉末 | t5 |
(2)由表格中的信息可知实验二的目的是探究影响化学反应速率的因素
(3)实验①和实验②是探究浓度对该化学反应速率的影响,分析表格中的信息可知,对该化学反应速率的影响因素还有温度、接触面积
(4)收集a ml CO2所需的时间最少的实验是⑤(填实验序号)
14.相同条件下,相同质量的乙烯和CO具有相同的( )
(1)分子数(2)体积(3)密度(4)原子数.
(1)分子数(2)体积(3)密度(4)原子数.
| A. | 仅(1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | 以上都不相同 |
4.冶炼不活泼金属Ag最合适的方法为( )
| A. | 热还原法 | B. | 电解法 | C. | 热分解法 | D. | 以上方法均不可 |
8.下列设计的实验方案能达到实验目的是( )
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检溶液,向其中加入浓NaOH溶液加热,再用湿润的蓝色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量的苯酚的苯中加入过量的浓溴水,震荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 除去淀粉溶液中的氯化钠:用蒸馏水渗析法 |
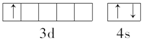 ,该元素基态原子结构示意图
,该元素基态原子结构示意图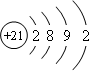 .该元素的名称为钪,形成的单质为金属晶体.
.该元素的名称为钪,形成的单质为金属晶体. 中心原子的杂化方式为
中心原子的杂化方式为
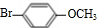 .
.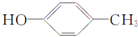 .
.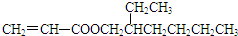 $→_{Na_{2}CO_{3}/NMP}^{Pd/C}$
$→_{Na_{2}CO_{3}/NMP}^{Pd/C}$ 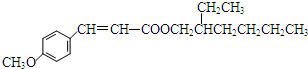 +HBr.
+HBr.