题目内容
8.如图是某水溶液在 pH 从 0 至 14 的范围内 H2CO3、HCO3-、CO2-组成分数.下列叙述正确的是( )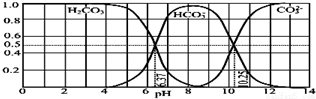
| A. | 此图是 1.0mol•L-1 碳酸钠溶液滴定 1.0mol•L-1 HCl 溶液的滴定曲线 | |
| B. | 在 pH 分别为 6.37 及 10.25 时,溶液中 c(H2CO3)=c(HCO3-)=c(CO32-) | |
| C. | 人体血液的 pH 约为 7.4,则CO2 在血液中多以 HCO3形式存在 | |
| D. | 若用CO2和NaOH反应制取Na2CO3易控制溶液的pH为7~9之间 |
分析 A.1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液,在碳酸浓度达到饱和之前,浓度应逐渐增大,且起始浓度不可能为1.0mol/L;
B.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),物质的量分数相等,但是溶液的体积不相等;
C.由图可知,pH为7.4时,HCO3-的浓度远远大于碳酸的浓度;
D.根据图可知,pH在7~9之间时,溶液中主要以碳酸氢根离子形式存在.
解答 解:A.1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液,在碳酸浓度达到饱和之前,碳酸浓度应逐渐增大,且起始浓度不可能为1.0mol/L,故A错误;
B.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),由于溶液的体积不相等,所以三者的浓度不相等,故B错误;
C.由图可知,pH为7.4时,HCO3-的物质的量远远大于碳酸的,则当人体血液的pH约为7.4,CO2在血液中多以HCO3-的形式存在,故C正确;
D.由图可知,溶液的pH为7~9之间时,溶液中的阴离子主要以HCO3-形式存在,溶液中的溶质主要为碳酸氢钠,所以若用CO2和NaOH反应制取NaHCO3,溶液的pH应该控制在7~9之间,故D错误;
故选C.
点评 本题考查学生的识图和应用能力,题目难度中等,正确分析图象中pH与离子的浓度关系是解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
18.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素.下列说法正确的是( )
| X | ||||||
| Y | Z | W |
| A. | 工业上电解ZW3饱和溶液冶炼金属Z | |
| B. | 元素X的最高正价与W的最高正价相同 | |
| C. | 简单离子半径的大小顺序:r(X-)<r(Y+) | |
| D. | Y、W的最高价氧化物的水化物均能溶解金属Z |
19.阿伏加德罗常数为 NA,下列说法正确的是( )
| A. | 1 mol 钠与氧气反应生成 Na2O 或 Na2O2时,失电子数目均为 NA | |
| B. | 1 mol/L 的 NaOH 溶液中含 Na+数目为 NA | |
| C. | 标准状况下,2.24LC6H6 所含的分子数目为 0.1NA | |
| D. | 1 mol Na2O2 中含有的阴离子数目为 2NA |
16.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出5m3CO2 |
13.保存下列物质的方法正确是( )
| A. | 氢氟酸保存在用塑料盖的玻璃瓶中 | |
| B. | 稀硫酸可以用铁桶贮存 | |
| C. | 氯水盛放在棕色的玻璃瓶中 | |
| D. | 水玻璃保存在带有玻璃塞的玻璃瓶中 |
17.N2O俗称“笑气”.它属于( )
| A. | 氧化物 | B. | 盐 | C. | 酸 | D. | 单质 |
18.下列实验或叙述不符合绿色化学理念的是( )
| A. | 制CuSO4时先将Cu氧化成CuO后再与稀硫酸反应 | |
| B. | 采用银作催化剂,乙烯和氧气制取环氧乙烷,原子利用率100% | |
| C. | 用乙醇代替汽油作汽车燃料 | |
| D. | 用稀硝酸和铜制取Cu(NO3)2 |
 、
、 .
.