题目内容
16.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出5m3CO2 |
分析 工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,其反应方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应在S元素的化合价从-2价升高到+2价,S的化合价从+4价降低到+2价,据此分析.
解答 解:A.由反应方程式中S元素的化合价变化可知,硫元素既被氧化又被还原,故A正确;
B.2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中,Na2S为还原剂,SO2为氧化剂,则氧化剂与还原剂的物质的量之比为2:1,故B错误;
C.反应中2Na2S转化为3Na2S2O3,转移8个电子,则生成1molNa2S2O3,转移$\frac{8}{3}$mol电子,故C错误;
D.根据方程式可知,每当4molSO2参与氧化还原反应就会放出1molCO2,则每10m3SO2参与反应就会放出2.5m3CO2,由于二氧化碳溶于水,所以产生的二氧化碳少于2.5m3,故D错误.
故选A.
点评 本题考查了氧化还原反应,注意根据反应物和生成物写出反应方程式,结合元素化合价的变化分析,题目难度中等.

练习册系列答案
相关题目
6.下列说法中正确的是( )
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 熵值增大的反应都能自发进行 | |
| C. | 由能量判据和熵判据组合而成的复合判据,适合于所有的反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
4.常温下,pH=2的二元弱酸H2R溶液与pH=12的NaOH溶液混合后,混合液的pH=7,下列判断正确的是.
| A. | 两溶液一定是等体积混合 | B. | 溶液中:c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+) | ||
| C. | 溶液中2c(R2-)+c(HR-)=c(Na+) | D. | 溶液中:c(HR-)>c(Na+)>c(H+)=c(OH-) |
11.生活是化学的源泉.下列叙述不正确的是( )
| A. | 可溶性铜盐有毒,故人体内不存在铜元素 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | 宇航服主要成分是由碳化硅陶瓷和碳纤维复合而成,是一种新型无机非金属材料 | |
| D. | 中秋佳节月饼中用小袋包装的铁粉来防止月饼氧化变质 |
1.以下是元素周期表的一部分,回答下列有关问题:
(1)与水反应最剧烈的金属元素是K;元素构成的最稳定气态氢化物的化学式是HF;③、④、⑧元素原子半径由大到小是Si>N>O(用元素符号作答).
(2)表中⑦元素形成的两性氢氧化物化学式是Al(OH)3,写出该元素的单质与⑥最高 价氧化物的水化物反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)②、④两种元素形成某气体化合物是导致温室效应的主要原因,该化合物的电子式为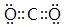 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程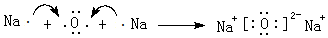 .
.
(4)②的单质与③的最高价氧化物的水化物的浓溶液反应化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
(2)表中⑦元素形成的两性氢氧化物化学式是Al(OH)3,写出该元素的单质与⑥最高 价氧化物的水化物反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)②、④两种元素形成某气体化合物是导致温室效应的主要原因,该化合物的电子式为
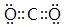 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程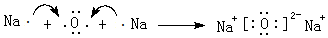 .
.(4)②的单质与③的最高价氧化物的水化物的浓溶液反应化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
8.如图是某水溶液在 pH 从 0 至 14 的范围内 H2CO3、HCO3-、CO2-组成分数.下列叙述正确的是( )
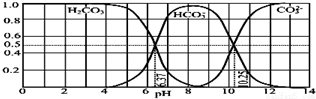

| A. | 此图是 1.0mol•L-1 碳酸钠溶液滴定 1.0mol•L-1 HCl 溶液的滴定曲线 | |
| B. | 在 pH 分别为 6.37 及 10.25 时,溶液中 c(H2CO3)=c(HCO3-)=c(CO32-) | |
| C. | 人体血液的 pH 约为 7.4,则CO2 在血液中多以 HCO3形式存在 | |
| D. | 若用CO2和NaOH反应制取Na2CO3易控制溶液的pH为7~9之间 |
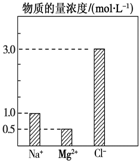 在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题: