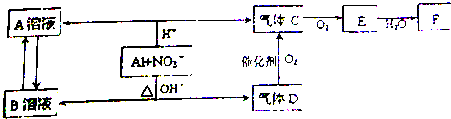
题目内容
17.N2O俗称“笑气”.它属于( )| A. | 氧化物 | B. | 盐 | C. | 酸 | D. | 单质 |
分析 两种元素组成其中一种为氧元素的化合物为氧化物,
金属阳离子和酸根阴离子构成的化合物为盐,
水溶液中电离出的阳离子全部是氢离子的化合物为酸,
一种元素组成的纯净物为单质,依据概念和物质组成分析判断.
解答 解:N2O俗称“笑气”物质是氮氧两种元素组成的化合物属于氧化物,故选A.
点评 本题考查了物质分类、物质组成的分析判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
8.如图是某水溶液在 pH 从 0 至 14 的范围内 H2CO3、HCO3-、CO2-组成分数.下列叙述正确的是( )
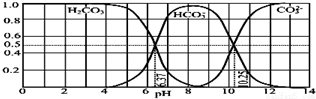

| A. | 此图是 1.0mol•L-1 碳酸钠溶液滴定 1.0mol•L-1 HCl 溶液的滴定曲线 | |
| B. | 在 pH 分别为 6.37 及 10.25 时,溶液中 c(H2CO3)=c(HCO3-)=c(CO32-) | |
| C. | 人体血液的 pH 约为 7.4,则CO2 在血液中多以 HCO3形式存在 | |
| D. | 若用CO2和NaOH反应制取Na2CO3易控制溶液的pH为7~9之间 |
2.下列对4g氦气的说法正确的是( )
| A. | 标准状况下的体积为11.2L | B. | 含NA个氦气分子 | ||
| C. | 含NA个电子 | D. | 物质的量为0.5mol |
9.某有机物(仅含碳、氢、氧)的相对分子量在50~100之间,经分析得知,其中氧质量分数为36.37%.有关其同分异构体数目的说法错误的是( )
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 既含有羟基又含有醛基的有3种 | |
| D. | 存在分子中含有六元环的同分异构体 |
7.现有a L乙烷、乙烯和氢气的混合气体,在一定条件下充分反应得到b L气体(温度、压强相同),将反应后气体通入酸性高锰酸钾溶液中,气体体积不变.则原气体中乙烯的体积分数为( )
| A. | $\frac{a}{a+b}$ | B. | $\frac{a-b}{a+b}$ | C. | $\frac{a-b}{a}$ | D. | $\frac{a+b}{a}$ |
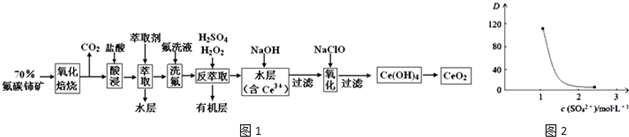
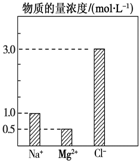 在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题: