题目内容
16.如表是元素周期表的一部分.X、Y、Z、W均为短周期主族元素.下列说法可能正确的是( )| X | Y | ||
| Z | W |
| A. | 元素的最高化合价Z大于Y | |
| B. | 元素的气态氢化物的稳定性W强于Y | |
| C. | 原子半径Z比Y小 | |
| D. | 元素的最高价氧化物的水化物酸性X大于W |
分析 由元素在周期表中的位置可知X、Z,Y、W分别位于同一主族,X、Y,Z、W分别位于同于周期,结合同周期、同主族元素的递变规律解答该题.
解答 解:A.如Y为F,则Z为P,F无正价,则元素的最高化合价Z大于Y,故A正确;
B.非金属性Y>W,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.一般来说,原子核外电子层数越多,原子半径越大,Z比Y多一个电子层,则Z的原子半径较大,故C错误;
D.如X为N,在W为Cl,Cl的最高价氧化物的水化物酸性最强,故D错误.
故选A.
点评 本题考查元素周期表、元素周期律、物质性质等,为高频考点,侧重于学生的分析能力的考查,难度不大,把握元素周期表是关键,根据物质判断各物质在周期表中所处周期.

练习册系列答案
相关题目
6.下列变化不属于化学变化的是( )
①皂化反应
②给装有氯化铵的试管加热,在管口又有白色晶体产生
③太阳光照在装有氯水的瓶子上,瓶子里有气泡产生
④碘受热有紫色蒸气产生
⑤碳酸钠晶体的风化
⑥向皂化后的溶液中加入氯化钠粉末使肥皂析出
⑦铁、铝常温遇浓硫酸发生钝化
⑧二氧化氮气体遇冷颜色变浅.
①皂化反应
②给装有氯化铵的试管加热,在管口又有白色晶体产生
③太阳光照在装有氯水的瓶子上,瓶子里有气泡产生
④碘受热有紫色蒸气产生
⑤碳酸钠晶体的风化
⑥向皂化后的溶液中加入氯化钠粉末使肥皂析出
⑦铁、铝常温遇浓硫酸发生钝化
⑧二氧化氮气体遇冷颜色变浅.
| A. | ①⑤⑥ | B. | ④⑥ | C. | ②④⑦ | D. | ③④⑧ |
7.配制500mL 0.5mol/L的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为10.0g.
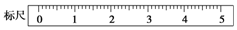
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将(填“高于”或“低于”)右边的托盘.欲使天平平衡,所进行的操作为将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡.假定最终称得小烧杯的质量为32.6(填“32.6g”或“31.61g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示).
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温.
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm.
③将NaOH溶液沿玻璃棒注入500mL容量瓶中.
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶.
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
试将以上操作排出先后顺序①③④②⑤.
(4)某学生实际配制NaOH溶液的浓度为0.48mol/L,原因可能是ACD.
A.使用滤纸称量氢氧化钠固体 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水后定容时仰视刻度.
(1)计算:需要NaOH固体的质量为10.0g.
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将(填“高于”或“低于”)右边的托盘.欲使天平平衡,所进行的操作为将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡.假定最终称得小烧杯的质量为32.6(填“32.6g”或“31.61g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示).
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) |

(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温.
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm.
③将NaOH溶液沿玻璃棒注入500mL容量瓶中.
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶.
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
试将以上操作排出先后顺序①③④②⑤.
(4)某学生实际配制NaOH溶液的浓度为0.48mol/L,原因可能是ACD.
A.使用滤纸称量氢氧化钠固体 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水后定容时仰视刻度.
11.下列实验设计不能达到预期目的是( )
| 实验设计 | 预期目的 | |
| A | 在相同温度下,分别取等质量的大理石块、大理石粉末分别与等体积等浓度的稀硫酸反应 | 探究反应物接触面积对化学反应速率的影响 |
| B | 把盛有颜色相同的NO2和N2O4的混合气体的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 将铁棒和石墨用导线连接后插入含有Fe2+、Cu2+的盐溶液中 | 探究Fe2+和Cu2+的氧化性相对强弱 |
| D | 相同温度下,向两支盛有等体积等浓度H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液 | 探究不同催化剂对同一反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
1.用NA表示阿伏加德罗常数的数值,下列判断正确的是( )
| A. | 1molO2参加反应转移电子数一定为4NA | |
| B. | 一定条件下,足量铜与2 mol的浓硫酸充分反应,转移电子数为2NA | |
| C. | 300mL2mol/L乙醇溶液中所含乙醇分子数为0.6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
8.下列说法正确的是( )
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 酒精、硫酸钡和水分别属于电解质、强电解质和弱电解质 | |
| C. | 胶体区别于其它分散系的本质特性是具有丁达尔现象 | |
| D. | 利用半透膜可除去淀粉溶液中的少量NaCl |
5.一定量的盐酸跟过量的锌粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
| A. | Ca(NO3 )2(溶液) | B. | K2CO3(溶液) | C. | CH3COOK(固体) | D. | CuSO4 (固体) |
6.下列判断正确的是( )
| A. | 常温常压下,溶解度小的无机盐不可能转化为溶解度相对大些的无机盐 | |
| B. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| C. | 相同条件下,1L0.1mol/L的碳酸钠溶液的pH大于2L0.1mol/L的醋酸钠溶液的pH | |
| D. | 1L 1mol/L的碳酸钠溶液吸收S02的量大于1L 1mol/L硫化钠溶液吸收SO2的量 |
 .
.