题目内容
3.甲、乙、丙、丁四种有机物的结构如表:| 甲的球棍模型 | 乙的结构式 | 丙的球棍模型 | 丁的比例模型 |
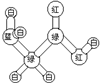 | 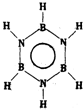 | 丙的分子式为C13H10O3 | 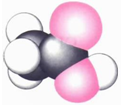 |
下列叙述不正确的是( )
| A. | 甲可代表氨基酸 | B. | 乙的二氯代物有3种 | ||
| C. | 丙的结构简式为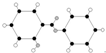 | D. | 丁可代表乙酸 |
分析 A.碳原子形成四个共价键,氮原子形成三个共价键,氧原子形成两个共价键,氢原子形成一个共价键,球棍模型中“棍”代表单键或双键或三键;
B.固定一个氯原子,有两种,然后加入另一个氯原子分析判断存在的同分异构体;
C.结合碳原子形成四个共价键,氧原子形成两个共价键,氢原子形成一个共价键,球棍模型中黑色为碳原子,暗色球为氧原子,白色球为氢原子;
D.比例模型中黑球为碳原子,红球为氧原子,白球为氢原子,据此写出结构简式判断;
解答 解:A.球棍模型中球的颜色不同属于不同原子,“棍”代表单键或双键或三键,可以表示氨基乙酸,CH2(NH2)-COOH,可以代表氨基酸,故A正确;
B.固定一个氯原子,有两种,然后加入另一个氯原子,邻、间、对三种同分异构体,改变第一个氯原子位置,则间位连接另一个氯原子形成一种同分异构体,有四种,故B错误;
C.结合碳原子形成四个共价键,氧原子形成两个共价键,氢原子形成一个共价键,球棍模型中黑色为碳原子,暗色球为氧原子,白色球为氢原子,计算得到分子式为:C13H10O3,故C正确;
D. 比例模型中黑球为碳原子,红球为氧原子,白球为氢原子,可以表示乙酸的比例模型,故D正确;
比例模型中黑球为碳原子,红球为氧原子,白球为氢原子,可以表示乙酸的比例模型,故D正确;
故选B.
点评 本题考查了有机物的结构简式、球棍模型、比例模型等表示方法,掌握基础是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 碳酸钠(固体) | B. | 水 | C. | 稀盐酸 | D. | 硫酸铵(固体) |
13.已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,下列反应的化学方式或叙述不成立的是( )
| A. | Z2与X-在水溶液中不能大量共存 | |
| B. | 还原性:Y->Z->W- | |
| C. | 2NaW+Y2=2NaY+W2 | |
| D. | W2通入到NaX和NaY的混合溶液中:W2优先氧化Y- |
8.某温度时,BaCO3在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
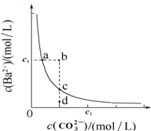

| A. | 通过蒸发可以使溶液由d点变到c点 | |
| B. | b点有BaCO3沉淀生成 | |
| C. | 升高温度,可以使d点变为c点 | |
| D. | 在a点加入Na2CO3,达平衡时c(Ba2+)≠c(CO32-),其Ksp大于c点对应的Ksp |
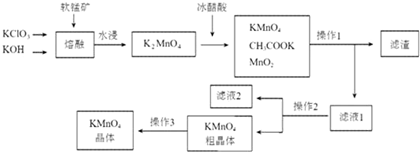
15.高锰酸钾是一种常用的氧化剂.下图是利用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺(流程中部分产物已略去):
相关物质不同温度下的溶解度(单位:g)数据如表:
(1)“熔融”步骤反应的化学方程式为3MnO2+KClO3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O.
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-.
(3)操作2是蒸发浓缩、冷却结晶、过滤.
(4)图中可以直接进行循环利用的物质是(填化学式)MnO2.
(5)KMnO4粗晶体中的主要杂质(填化学式)有KCl和CH3COOK;操作3用到的试剂蒸馏水和硝酸银溶液;若用硫酸代替图中的冰醋酸,则导致的问题及原因是反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低或硫酸酸性太强,导致MnO4-将Cl-氧化,产生有毒的Cl2,KMnO4损失且纯度降低.

相关物质不同温度下的溶解度(单位:g)数据如表:
| 物质 温度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-.
(3)操作2是蒸发浓缩、冷却结晶、过滤.
(4)图中可以直接进行循环利用的物质是(填化学式)MnO2.
(5)KMnO4粗晶体中的主要杂质(填化学式)有KCl和CH3COOK;操作3用到的试剂蒸馏水和硝酸银溶液;若用硫酸代替图中的冰醋酸,则导致的问题及原因是反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低或硫酸酸性太强,导致MnO4-将Cl-氧化,产生有毒的Cl2,KMnO4损失且纯度降低.
12.如表是元素周期表的一部分,回答下列有关问题:
(1)写出②的离子结构示意图 ①的气态氢化物的电子式
①的气态氢化物的电子式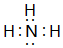 .
.
(2)写出⑪元素基态原子的价电子排布式4s2.
(3)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的离子方程式:Al(OH)3+3H+=Al3++3H2O.
(4)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该反应化学方程式NH3+HNO3=NH4NO3或 2H2S+H2SO4(浓)=3H2O+2S+SO2.
(5)如何证明元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方程式S2-+Cl2=S↓+2Cl-.
(6)在这些元素中VIIA氢化物的稳定性由强到弱HF>HCl>HBr(用化学式作答)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ①的气态氢化物的电子式
①的气态氢化物的电子式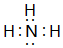 .
.(2)写出⑪元素基态原子的价电子排布式4s2.
(3)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的离子方程式:Al(OH)3+3H+=Al3++3H2O.
(4)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该反应化学方程式NH3+HNO3=NH4NO3或 2H2S+H2SO4(浓)=3H2O+2S+SO2.
(5)如何证明元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方程式S2-+Cl2=S↓+2Cl-.
(6)在这些元素中VIIA氢化物的稳定性由强到弱HF>HCl>HBr(用化学式作答)
 苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.
苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.