题目内容
1.煤、石油、天然气、动植物体、石灰石、白云石、二氧化碳等都含有碳元素.请回答下列问题:(1)COCl2俗称光气,分子中C原子采取sp2杂化成键,应用价层电子对互斥理论,预测COCl2 分子的空间构型为平面三角形.
(2)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,实验室测定铁的含量:可用配位剂邻二氮菲(
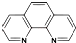 ),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.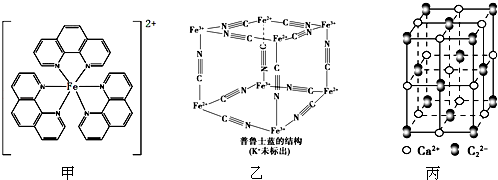
(3)普鲁士蓝可用作燃料,立方体结构如图24乙所示.普鲁士蓝中,n(K+):n(Fe3+):n(Fe2+):n(CN-)=1:1:1:6.
(4)CaC2晶体的晶胞结构与NaCl晶体相似(如图丙).
①纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图,
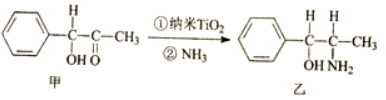
甲中采取sp2杂化的碳原子有7个,乙中各元素的电负性由大到小的顺序为O>N>C>H.
②CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为
 ,其中σ键与π键数目之比为1:2.
,其中σ键与π键数目之比为1:2.③该晶胞中Ca2+、C22-之间的最近距离为a pm,则该CaC2的密度为$\frac{\frac{64}{{N}_{A}}×4}{(2a×1{0}^{-10})^{3}}$g/cm3(NA为阿伏加德罗常数,只列计算式),该晶体中与C22-距离相等且最近的C22-有12个.
④X-射线表明KCl、CaO与NaCl晶体结构相似,三种离子晶体熔点由高到低的顺序为CaO>NaCl>KCl.
分析 (1)C原子价层电子对个数是3且不含孤电子对;
(2)Fe原子和N原子之间形成配位键;
(3)利用均摊法计算以及电荷守恒计算;
(4)①C原子价层电子对个数为3且不含孤电子对的采用sp2杂化,元素的非金属性越强,其电负性越大;
②等电子体的结构相似,故O22+的电子式与C22-的电子式相似,该离子中含有1个σ键、2个π键;
③该晶胞中钙离子个数=1+12×$\frac{1}{4}$=4、C22-离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Ca2+、C22-之间的最近距离为a pm=a×
10-10 cm,则该晶胞体积=(2a×10-10 cm)3,晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$,该晶胞中与C22-距离相等且最近的C22-个数=3×8÷2;
④这几种晶体都是离子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比.
解答 解:(1)C原子价层电子对个数是3且不含孤电子对,所以其空间构型为平面三角形,故答案为:平面三角形;
(2)Fe原子和N原子之间形成配位键,该配合物中含有6个N原子,所以有6个配位键,故答案为:6;
(3)Fe3+离子的个数为:4×$\frac{1}{8}$=$\frac{1}{2}$;Fe2+离子的个数为:4×$\frac{1}{8}$=$\frac{1}{2}$;CN一离子的个数为:12×$\frac{1}{4}$=3,
根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN一),得N(K+)=$\frac{1}{2}$,
普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN一)=1:1:1:6,
故答案为:1:1:1:6;
(4)①C原子价层电子对个数为3且不含孤电子对的采用sp2杂化,苯环上C原子和连接羰基的碳原子都采用sp2杂化,
元素的非金属性越强,其电负性越大,所以这几种元素电负性大小顺序是O>N>C>H,
故答案为:7;O>N>C>H;
②根据等电子体的结构相似,则O22+的电子式  ,该离子中含有1个σ键、2个π键,所以σ键、π键个数之比为1:2,
,该离子中含有1个σ键、2个π键,所以σ键、π键个数之比为1:2,
故答案为: ;1:2;
;1:2;
③该晶胞中钙离子个数=1+12×$\frac{1}{4}$=4、C22-离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Ca2+、C22-之间的最近距离为a pm=a×
10-10 cm,则该晶胞体积=(2a×10-10 cm)3,晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{64}{{N}_{A}}×4}{(2a×1{0}^{-10})^{3}}$g/cm3,该晶胞中与C22-距离相等且最近的C22-个数=3×8÷2=12,
故答案为:$\frac{\frac{64}{{N}_{A}}×4}{(2a×1{0}^{-10})^{3}}$;12;
④这几种晶体都是离子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比,钙离子所带电荷大于钠离子、钾离子,氧离子所得电荷大于氯离子且半径小于氯离子,所以晶格能大小顺序是CaO>NaCl>KCl,则熔沸点大小顺序是CaO>NaCl>KCl,
故答案为:CaO>NaCl>KCl.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、熔沸点高低比较、原子杂化方式判断、微粒空间构型判断等知识点,侧重考查学生分析判断、计算及空间想象能力,难点是配位数的计算方法及等电子体电子式的书写,题目难度中等.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案①4HCl(浓)+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$ nCl2+Cl2↑+2H2O
②4HCl(g)+O2 $\frac{\underline{\;催化剂\;}}{△}$2Cl2+2H2O(g)
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
则三种氧化剂氧化性由强到弱的顺序是( )
| A. | O2 MnO2 KMnO4 | B. | KMnO4 MnO2O2 | ||
| C. | MnO2KMnO4 O2 | D. | O2 KMnO4 MnO2 |
| A. | 酒精和水 | B. | 汽油和水 | C. | 苯和水 | D. | 四氯化碳和水 |
(1)在如图图方格内画出实验装置图,
(3)外电路中的电子是从负(Zn)极流向正(Pt或石墨)极.
| A. | 碳酸钠(固体) | B. | 水 | C. | 稀盐酸 | D. | 硫酸铵(固体) |
| A. | Z2与X-在水溶液中不能大量共存 | |
| B. | 还原性:Y->Z->W- | |
| C. | 2NaW+Y2=2NaY+W2 | |
| D. | W2通入到NaX和NaY的混合溶液中:W2优先氧化Y- |
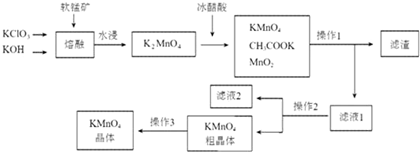
相关物质不同温度下的溶解度(单位:g)数据如表:
| 物质 温度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-.
(3)操作2是蒸发浓缩、冷却结晶、过滤.
(4)图中可以直接进行循环利用的物质是(填化学式)MnO2.
(5)KMnO4粗晶体中的主要杂质(填化学式)有KCl和CH3COOK;操作3用到的试剂蒸馏水和硝酸银溶液;若用硫酸代替图中的冰醋酸,则导致的问题及原因是反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低或硫酸酸性太强,导致MnO4-将Cl-氧化,产生有毒的Cl2,KMnO4损失且纯度降低.
| A. | 乙烯和乙炔属于不饱和烃,乙烷属于饱和烃 | |
| B. | 乙烯和乙炔分子中所有原子都在同一平面上,乙烷分子中所有原子不都在同一平面上 | |
| C. | 乙烯和乙炔都能发生加成反应,乙烷不能发生加成反应 | |
| D. | 在发生加成反应时,乙烯和乙炔分子中的碳碳键全部断裂 |



