题目内容
9.下列说法正确的是( )| A. | 标准状况下,20mL NH3跟60mL O2所含的分子个数比为1:3 | |
| B. | 22.4L O2中一定含有6.02×1023个氧分子 | |
| C. | 将80克NaOH溶于1L水中,所得溶液的物质的量浓度为2mol/L | |
| D. | 18克H2O在标准状况下的体积为0.018L |
分析 A.相同条件下,气体体积之比等于其分子数目之比;
B.标准状况下气体摩尔体积为22.4L/mol;
C.物质的量浓度中,体积为溶液体积;
D.18g的物质的量为1mol,标况下,水为液态,不能用气体摩尔体积计算其体积.
解答 解:A.同温同压下,气体体积之比等于其分子数目之比,故标准状况时,20mLNH3与60mL O2所含的分子个数比=20mL:60mL=1:3,故A正确;
B.温度压强不知,22.4L O2物质的量不是1mol,故B错误;
C.将80克NaOH溶于1L水中,氢氧化钠的物质的量为2mol,但是溶液的体积大于1L,所以所得溶液的物质的量浓度小于2mol/L,故C错误;
D.18g的物质的量为1mol,标况下,水为液态,不能用气体摩尔体积计算其体积,应根据V=$\frac{m}{ρ}$计算水的体积,其体积远远小于22.4L,故D错误;
故选A.
点评 本题考查气体摩尔体积,比较基础,注意气体摩尔体积的使用对象与条件,掌握基础是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列溶液:①硝酸钡溶液 ②碘水 ③酸性高锰酸钾溶液 ④氯化铁溶液 ⑤品红溶液,其中能用来区别SO2和CO2气体的是( )
| A. | ③⑤ | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
4.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 沉淀溶解后,将会生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| B. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| C. | 向反应后的溶液加入乙醇,溶液不会有变化,因为[Cu(NH3)4]2+不会与乙醇发生反应 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
14.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与浓度和反应温度有关.下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,由于溶液浓度不同而能发生不同氧化还原反应的是( )
| A. | ①③ | B. | ③④ | C. | ①② | D. | ①④ |
1.下述根据下列操作现象或事实,所得结论正确的是( )
| 实验操作及现象 | 实验结论 | |
| A | 分别向2mL 0.1mol•L-1 CH3COOH溶液和2mL 0.1mol•L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol•L-1 FeCl3溶液,出现红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| C | 过氧化钠用于呼吸面具中作为氧气的来源 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 向含有淀粉的FeI2溶液中滴加足量的氯水后变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
18.下列各组离子在给定条件下能大量共存的是( )
| A. | 在pH=1的溶液中:NH4+、K+、CO32-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- | |
| C. | 无色透明水溶液中:K+、Ba2+、I-、NO3- | |
| D. | 与铝粉反应有氢气生成的溶液中:Na+、Cl-、SO42-、HCO3- |
19.硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等.利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如图1:
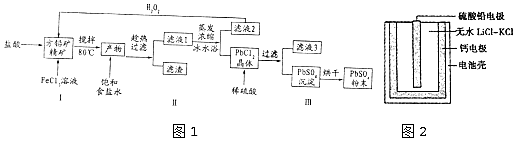
已知:(i) PbCl2 (s)+2C1-(aq)═PbCl42-(aq)△H>0
(ii)有关物质的Ksp和沉淀时的pH如表:
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式PbS+2Fe3++2Cl-=PbCl2+2Fe2++S↓.
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使吸热反应PbCl2(s)+2Cl-(aq)?PbCl4-(aq)逆向移动,使PbCl4-不断转化为PbCl2晶体而析出.
(3)在上述生产过程中可以循环利用的物质有FeCl3和盐酸.
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)?PbSO4(s)+2Cl-(aq).
(5)PbSO4热激活电池可用作火箭、导弹的工作电源.基本结构如图2所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.
①放电过程中,Li+向正极移动(填“负极”或“正极”).
②负极反应式为Ca+2Cl--2e-═CaCl2.
③电路中每转移0.2mol电子,理论上生成20.7g Pb.

已知:(i) PbCl2 (s)+2C1-(aq)═PbCl42-(aq)△H>0
(ii)有关物质的Ksp和沉淀时的pH如表:
| 物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
| PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Fe(OH)2 | 6 | 7.04 |
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使吸热反应PbCl2(s)+2Cl-(aq)?PbCl4-(aq)逆向移动,使PbCl4-不断转化为PbCl2晶体而析出.
(3)在上述生产过程中可以循环利用的物质有FeCl3和盐酸.
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)?PbSO4(s)+2Cl-(aq).
(5)PbSO4热激活电池可用作火箭、导弹的工作电源.基本结构如图2所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.
①放电过程中,Li+向正极移动(填“负极”或“正极”).
②负极反应式为Ca+2Cl--2e-═CaCl2.
③电路中每转移0.2mol电子,理论上生成20.7g Pb.