题目内容
14.在化学实验中有时可以不使用任何化学试剂,通过相互滴加的方法就能将两种物质鉴别开来,下列各组中不能用此法鉴别的是( )| A. | KOH和Al2(SO4)3 | B. | NaOH和Ca(HCO3)2 | C. | NaAlO2和 HCl | D. | K2CO3和HNO3 |
分析 只要用试管和胶头滴管,不用任何化学试剂就可以鉴别的物质可以采用相互滴加的方法检验,滴加顺序不同,现象不同的可以鉴别.反之不能鉴别,以此解答该题.
解答 解:A.KOH和Al2(SO4)3滴加顺序不同,现象不同,将KOH滴加到Al2(SO4)3中,先生成沉淀,后溶解,将Al2(SO4)3滴加到KOH中,先没有现象,后生成沉淀,二者反应现象不同,可鉴别,故A不选;
B.无论是Ca(HCO3)2滴加到NaOH中,还是NaOH滴加到Ca(HCO3)2中,都产生碳酸钙沉淀,不能鉴别,故B选;
C.盐酸滴加到偏铝酸钠溶液中,先生成沉淀,后沉淀溶解,偏铝酸钠滴加到盐酸中,先无沉淀,后生成沉淀,现象不同,可鉴别,故C不选;
D.HNO3滴加到中K2CO3,开始不生成气体,HNO3足量生成气体,碳酸钾滴加到硝酸中立即生成气体,不用任何化学试剂改变滴定顺序就可以鉴别,故D不选.
故选B.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、与量有关的反应和现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物性质的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 沉淀溶解后,将会生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| B. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| C. | 向反应后的溶液加入乙醇,溶液不会有变化,因为[Cu(NH3)4]2+不会与乙醇发生反应 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
5.化学基本概念及原理在化学反应中应用广泛.
(1)甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,反应如下:
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1 K1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2 K2
③CO(g)+2H2(g)?CH3OH(g)△H3 K3
已知相关的化学键键能(E)数据如表:
已知△H2=+41kJ•mol-1,则△H3=-220kJ•mol-1;平衡常数K3=$\frac{{K}_{1}}{{K}_{2}}$(用K1、K2表示).
(2)NaAlH4是重要的还原剂和储氢材料.可由甲合成NaAlH4,加热7.20g甲至完全分解,得到金属钠和3.36L(标准状况)的H2.
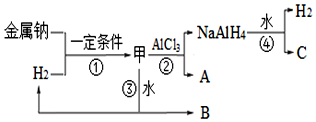
①A的电子式为Na+[:H]-;反应③的化学方程式为NaH+H2O=H2↑+NaOH.
②NaAlH4在催化剂作用下释放氢时生成Na3AlH6和两种单质,则该反应的化学方程式为3NaAlH4=Na3AlH6+3H2↑+2Al.
③为制备甲并检验其是否纯净,某同学设计方案:用惰性气体赶尽反应体系中的空气,将锌和稀硫酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质;取该固体物质与水反应,产生H2,证明固体物质一定是纯净的.该同学设计的方案是否合理并说明理由不合理,Na和NaH都能与水反应生成H2.
(1)甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,反应如下:
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1 K1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2 K2
③CO(g)+2H2(g)?CH3OH(g)△H3 K3
已知相关的化学键键能(E)数据如表:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 745 | 465 | 413 |
(2)NaAlH4是重要的还原剂和储氢材料.可由甲合成NaAlH4,加热7.20g甲至完全分解,得到金属钠和3.36L(标准状况)的H2.

①A的电子式为Na+[:H]-;反应③的化学方程式为NaH+H2O=H2↑+NaOH.
②NaAlH4在催化剂作用下释放氢时生成Na3AlH6和两种单质,则该反应的化学方程式为3NaAlH4=Na3AlH6+3H2↑+2Al.
③为制备甲并检验其是否纯净,某同学设计方案:用惰性气体赶尽反应体系中的空气,将锌和稀硫酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质;取该固体物质与水反应,产生H2,证明固体物质一定是纯净的.该同学设计的方案是否合理并说明理由不合理,Na和NaH都能与水反应生成H2.
9.以下有机物同分异构体数目判断中不正确的是( )
| A. | 立方烷( 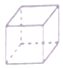 )的六氨基(-NH2)取代物有3种 )的六氨基(-NH2)取代物有3种 | |
| B. | C3H7ClO(有羟基)的同分异构体数目有5种 | |
| C. | 甲苯与氢气充分加成后的一溴代物有4种 | |
| D. | 分子式为C5H10O2的有机物中能与NaOH溶液反应的有13种 |
19.硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等.利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如图1:
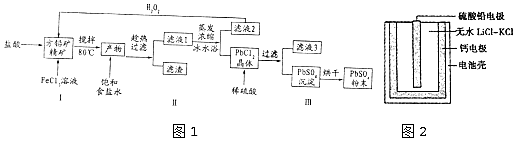
已知:(i) PbCl2 (s)+2C1-(aq)═PbCl42-(aq)△H>0
(ii)有关物质的Ksp和沉淀时的pH如表:
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式PbS+2Fe3++2Cl-=PbCl2+2Fe2++S↓.
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使吸热反应PbCl2(s)+2Cl-(aq)?PbCl4-(aq)逆向移动,使PbCl4-不断转化为PbCl2晶体而析出.
(3)在上述生产过程中可以循环利用的物质有FeCl3和盐酸.
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)?PbSO4(s)+2Cl-(aq).
(5)PbSO4热激活电池可用作火箭、导弹的工作电源.基本结构如图2所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.
①放电过程中,Li+向正极移动(填“负极”或“正极”).
②负极反应式为Ca+2Cl--2e-═CaCl2.
③电路中每转移0.2mol电子,理论上生成20.7g Pb.

已知:(i) PbCl2 (s)+2C1-(aq)═PbCl42-(aq)△H>0
(ii)有关物质的Ksp和沉淀时的pH如表:
| 物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
| PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Fe(OH)2 | 6 | 7.04 |
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使吸热反应PbCl2(s)+2Cl-(aq)?PbCl4-(aq)逆向移动,使PbCl4-不断转化为PbCl2晶体而析出.
(3)在上述生产过程中可以循环利用的物质有FeCl3和盐酸.
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)?PbSO4(s)+2Cl-(aq).
(5)PbSO4热激活电池可用作火箭、导弹的工作电源.基本结构如图2所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.
①放电过程中,Li+向正极移动(填“负极”或“正极”).
②负极反应式为Ca+2Cl--2e-═CaCl2.
③电路中每转移0.2mol电子,理论上生成20.7g Pb.
6.下列关于有机化合物的说法不正确的是( )
| A. | 1,2-二甲苯也称邻二甲苯 | |
| B. | 氨基乙酸与a-氨基丙酸的混合物一定条件下脱水能生成4种二肽 | |
| C. | 苯与溴水不能发生加成反应,所以两者混合后无明显现象 | |
| D. | C5H10O2属于羧酸的同分异构体有4种 |
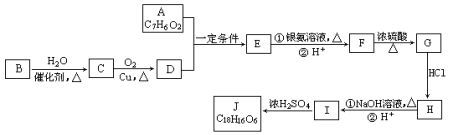
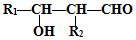
 ,G中含氧官能团的名称羟基、羧基.
,G中含氧官能团的名称羟基、羧基. $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$  +2H2O.
+2H2O.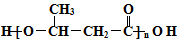 的路线图
的路线图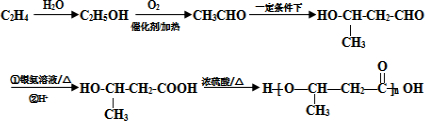 (提示:路线图的书写方法RCH=CH2
(提示:路线图的书写方法RCH=CH2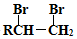 $→_{水/加热}^{NaOH}$
$→_{水/加热}^{NaOH}$ 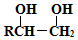 )
)