题目内容
3.对于2SO2(g)+O2(g)?2SO3(g)△H<0 反应来说:(1)若将2mol SO2气体和1mol O2气体在2L容器中混合并在一定条件下发生反应,经2min 建立平衡,此时测得 SO3浓度为 0.8mol•L-1,该条件时反应的平衡常数K=160L•mol-1.
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有B(填字母).
A.升高温度B.降低温度C.增大压强 D.移出生成的SO3
(3)一定温度下,若将8mol SO2气体和 4mol O2气体混合置于体积恒定的密闭容器中,能说明该反应已达到平衡状态的是BC.
A.SO2的转化率和O2的转化率相等
B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正
D.容器内密度保持不变
(4)一定温度下,将8mol SO2和4mol O2气体混合置于体积不变的密闭容器中,经t1时间达到平衡,测得混合气体总物质的量为10mol.若使SO2、O2、SO3三种气体均增加1mol,则平衡向右移动(填“向左移动”、“向右移动”或“不移动”).
分析 (1)经2min 建立平衡,此时测得 SO3浓度为 0.8mol•L-1,则
2SO2(g)+O2(g)?2SO3(g)
开始 1 0.5 0
转化 0.8 0.4 0.8
平衡 0.2 0.1 0.8
结合平衡浓度计算K;
(2)K只与温度有关;
(3)结合平衡的特征“等、定”及衍生的物理量判定;
(4)2SO2(g)+O2(g)?2SO3(g)
开始 8 4 0
转化 x 0.5x x
平衡 8-x 4-0.5x x
测得混合气体总物质的量为10mol,则8-x+4-0.5x+x=10,解得x=4,
则平衡时物质的量分别为4mol、2mol、4mol,
使SO2、O2、SO3三种气体均增加1mol,物质的量分别为5mol、3mol、5mol,浓度分别为2.5mol/L、1.5mol/L、2.5mol/L,
Qc=$\frac{2.{5}^{2}}{1.5×2.{5}^{2}}$=0.67,与K比较判断反应方向.
解答 解:(1)(1)经2min 建立平衡,此时测得 SO3浓度为 0.8mol•L-1,则
2SO2(g)+O2(g)?2SO3(g)
开始 1 0.5 0
转化 0.8 0.4 0.8
平衡 0.2 0.1 0.8
K=$\frac{0.{8}^{2}}{0.{2}^{2}×0.1}$=160L•mol-1,
故答案为:160L•mol-1;
(2)K只与温度有关,该反应为放热反应,降低温度,平衡正向移动,K增大,故答案为:B;
(3)A.SO2的转化率和O2的转化率相等,不能判定平衡,故A不选;
B.该反应为体积不等的反应,则容器内压强保持不变,为平衡状态,故B选;
C.v(SO2)逆=2v(O2)正,可知正逆反应速率相等,为平衡状态,故C选;
D.质量、体积均不变,容器内密度始终保持不变,不能判定平衡,故D不选;
故答案为:BC;
(4)2SO2(g)+O2(g)?2SO3(g)
开始 8 4 0
转化 x 0.5x x
平衡 8-x 4-0.5x x
测得混合气体总物质的量为10mol,则8-x+4-0.5x+x=10,解得x=4,
则平衡时物质的量分别为4mol、2mol、4mol,
使SO2、O2、SO3三种气体均增加1mol,物质的量分别为5mol、3mol、5mol,浓度分别为2.5mol/L、1.5mol/L、2.5mol/L,
Qc=$\frac{2.{5}^{2}}{1.5×2.{5}^{2}}$=0.67<K,可知反应向右移动,
故答案为:向右移动.
点评 本题考查化学平衡计算,为高频考点,把握化学平衡三段法、K计算及平衡判定为解答的关键,侧重分析与计算能力的考查,注意(4)中Qc与K的应用,题目难度不大.

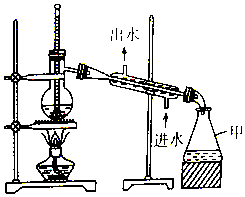
| A. | 仪器甲是锥形瓶,可直接用酒精灯加热 | |
| B. | 温度计水银球应该置于蒸馏烧瓶支管口处 | |
| C. | 直形冷凝管可用球形冷凝管代替 | |
| D. | 石油蒸馏时加沸石,制蒸馏水时不用加沸石 |
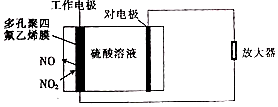 环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )
环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )| A. | “对电极”是负极 | |
| B. | “工作电极”上发生的电极反应为NO2+2e-+2H+═NO+H2O | |
| C. | 传感器工作时H+由工作电极移向对电极 | |
| D. | 对电极的材料可能为活泼金属锌 |
①CO(g)+2H2(g)═CH3OH(g)△H
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-58kJ•mol-1
③CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ•mol-1
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | x |
(2)若T℃时将6molCO2和 8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间的变化如图1中状态Ⅰ(图中实线)所示.图中数据A(1,6)代表在1min时H2的物质的量是6mol.
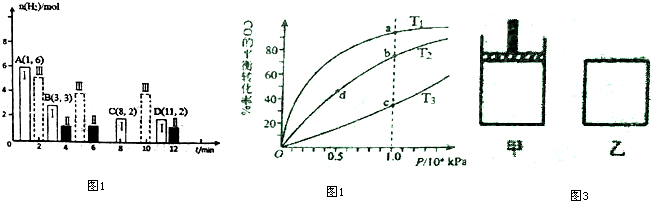
①T℃时状态I条件下,0--3min内CH3OH的平均反应速率v=0.28mol/(L•min)(保留两位有效数字),
平衡常数K=0.5;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是增大压强.
③一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是abc
a.容器中压强不变
b.CO2和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH )
d.气体的密度不再随时间的改变而变化
④CO与H2在密闭容器中发生反应①,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是A
A.温度:T1<T2<T3
B.正反应速率:v(a)>v(c);v(b)>v(d)
C.平衡常数:K(a)>K(c);K(b)>K(d)
D.平均摩尔质量:M(a)<M(c);M(b)>M(d)
⑤800K向下列起始体积相同的密闭容器中充入1molCO、2molH2发生反应①,如图3所示甲容器在反应过程中保持压强不变,乙容器保持体积不变达到平衡时H2的浓度c (H2)甲>c(H2)乙.
| A. | 乙酸乙酯的水解反应在碱性条件下比在酸性条件下水解更容易 | |
| B. | 油脂的水解可得到甘油,称为皂化反应 | |
| C. | 蛋白质水解的最终产物均为葡萄糖 | |
| D. | 淀粉水解和纤维素水解得到的最终产物相同,它们是同分异构体 |
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:Li>Na>K>Rb>Cs | ||
| C. | 酸性:HClO4>H2SO4>H2SeO4 | D. | 碱性:KOH>Mg(OH)2>Al(OH)3 |
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | FeCl2溶液中混有少量的FeCl3:加入足量的铁粉后过滤 | |
| D. | Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 |
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 晶格能由大到小:NaI>NaBr>NaCl>NaF | |
| C. | 熔点由高到低:Al>Mg>Na | |
| D. | 硬度由大到小:金刚石>碳化硅>晶体硅 |
