题目内容
13.下面的排序不正确的是( )| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 晶格能由大到小:NaI>NaBr>NaCl>NaF | |
| C. | 熔点由高到低:Al>Mg>Na | |
| D. | 硬度由大到小:金刚石>碳化硅>晶体硅 |
分析 A.均为分子晶体,相对分子质量越大,熔点越大;
B.离子晶体中离子键越强晶格能越大,电荷越多、离子半径越小,离子键越强;
C.影响金属晶体金属键强弱的因素为电荷和离子半径;
D.原子晶体中共价键越强,晶体硬度越大.
解答 解:A.均为分子晶体,相对分子质量越大,熔点越大,则晶体熔点由低到高:CF4<CCl4<CBr4<CI4,故A正确;
B.离子半径F-<Cl-<Br-<I-,故离子键强度NaF>NaCl>NaBr>NaI,故晶格能NaF>NaCl>NaBr>NaI,故B错误;
C.Na、Mg、Al原子半径依次减小,金属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低:Al>Mg>Na,故C正确;
D.原子半径Si>C,三者都为原子晶体,原子半径越大,共价键的键能越小,则硬度越小,则硬度由大到小:金刚石>碳化硅>晶体硅,故D正确.
故选B.
点评 本题考查晶体及性质,为高频考点,把握晶体类型及作用力、晶体性质比较方法为解答的关键,侧重分析与应用能力的考查,注意晶体结构与性质的应用,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
4.能用于鉴别Na2CO3固体和NaHCO3固体的方法是( )
| A. | 加稀盐酸 | B. | 加NaOH溶液 | C. | 焰色反应 | D. | 加热 |
1.下列说法啊正确的为( )
①植物油和裂化汽油都可以使溴水褪色
②煤经过气化、液化等物理变化可以得到清洁燃料
③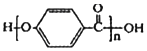 的结构中含有酯基
的结构中含有酯基
④1摩尔葡萄糖可以水解生成2摩尔乳酸(C3H6O3)
⑤聚合物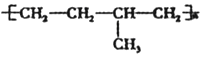 可由单体CH3-CH=CH2 和CH2=CH2加聚制得
可由单体CH3-CH=CH2 和CH2=CH2加聚制得
⑥煤含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯.
①植物油和裂化汽油都可以使溴水褪色
②煤经过气化、液化等物理变化可以得到清洁燃料
③
 的结构中含有酯基
的结构中含有酯基④1摩尔葡萄糖可以水解生成2摩尔乳酸(C3H6O3)
⑤聚合物
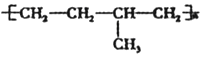 可由单体CH3-CH=CH2 和CH2=CH2加聚制得
可由单体CH3-CH=CH2 和CH2=CH2加聚制得⑥煤含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯.
| A. | ①③⑤ | B. | ①②⑤ | C. | ②④⑤ | D. | ②③④ |
8.图为元素周期表的一部分,根据元素①~⑧在周期表中的位置,按要求回答下列问题.
(1)在元素①~⑧中,金属性最强的元素是Na(填元素符号),最不容易形成化合物的元素是Ar(填元素符号).
(2)用电子式表示⑦的气态氢化物的形成过程 .
.
(3)③、④、⑥中原子半径由大到小的顺序是Na>S>F(填元素符号)
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
(2)用电子式表示⑦的气态氢化物的形成过程
 .
.(3)③、④、⑥中原子半径由大到小的顺序是Na>S>F(填元素符号)
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- | |
| B. | 稀硫酸中:K+、Mg2+、AlO2-、S2O32- | |
| C. | 常温下:$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| D. | 加入硫氰化钾显红色的溶液:K+、NH4+、Cl-、I- |
5.观察如图,下列叙述中错误的是( )


| A. | 图示实验中发生了化学变化 | |
| B. | 液体X的pH>7,液体Y是一种黑色黏稠状液体 | |
| C. | 气体Z易燃,可还原CuO | |
| D. | 液体Y是一种纯净物 |
3.在加热时,浓硫酸与铜发生反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.对于该反应,下列说法不正确的是( )
| A. | 是氧化还原反应 | B. | 铜是还原剂 | ||
| C. | 部分H2SO4被还原 | D. | Cu发生了还原反应 |

 .
.