题目内容
已知:C(金刚石,s)+O2(g)═CO2(g)△H=-398.41kJ/mol,C(石墨,s)+O2(g)═CO2(g)△H=-393.51kJ/mol,若取金刚石和石墨混合物1mol在O2中完全燃烧,产生热量Q kJ,则金刚石和石墨的物质的量之比为 (用含Q的代数式表示).
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:根据1mol金刚石和石墨分别在氧气中完全燃烧时放出的热量,利用十字交叉法来计算金刚石和石墨的物质的量之比.
解答:
解:C(金刚石,s)+O2(g)═CO2(g)△H=-398.41kJ/mol,C(石墨,s)+O2(g)═CO2(g)△H=-393.51kJ/mol,金刚石和石墨混合晶体共1mol 在O2中完全燃烧,产生热量为QkJ,
由十字交叉法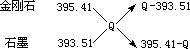 ,
,
可得二者物质的量比为
,
故答案为:
;
由十字交叉法
 ,
,可得二者物质的量比为
| Q-393.51 |
| 395.41-Q |
故答案为:
| Q-393.51 |
| 395.41-Q |
点评:本题考查金刚石和石墨的反应热与混合物的燃烧热量间的关系,注意学会利用十字交叉法来快速解答该类题型,题目难度不大.

练习册系列答案
相关题目
工业生产Na,Ca,Mg都用电解熔融的氯化物,但K不能用电解熔融态的方法得到,因金属钾易溶于熔融态的KCl而有危险,很难制得K,且降低电流效率.生产钾是用金属钠和熔化的KCl反应制取,有关反应式为:KCl+Na
NaCl+K↑下列说法错误的是( )
| ||
| A、该反应850℃的选择是基于熔沸点的考虑 |
| B、该反应利用了化学平衡移动的原理 |
| C、该反应属于置换反应的类型 |
| D、该反应表明钠比钾的活动性强 |
下列离子方程式正确的是( )
| A、AgNO3与NaCl溶液反应:Ag++Cl-=AgCl↓ | ||
| B、KCl溶液与F2反应:2Cl-+F2=Cl2+2F- | ||
| C、NaI溶液与Cl2反应:I-+Cl2=I2+Cl- | ||
D、CaCO3与盐酸反应:C
|
下列说法正确的是( )
| A、由H原子形成1mol H-H键要吸收热量 |
| B、所有燃烧反应都是放热反应 |
| C、在稀溶液中,酸与碱发生中和反应生成1 mol H2O时所释放的热量称为中和热 |
| D、凡经加热而发生的化学反应都是吸热反应 |

 有人研究了340K时N2O5的分解反应:2N2O5=4NO2+O2,所得实验数据(各种物质在不同时刻的浓度)见下表.
有人研究了340K时N2O5的分解反应:2N2O5=4NO2+O2,所得实验数据(各种物质在不同时刻的浓度)见下表.