题目内容
(1)乙醇(俗名酒精)分子式为C2H6O,其相对分子质量为 ,摩尔质量为 ;92g乙醇的物质的量为 ,配制成500mL溶液,其物质的量浓度为 ,从中取出5mL该溶液,约取出了 个乙醇分子.
(2)在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中, 是氧化剂; 是还原剂; 元素被氧化; 元素被还原; 是氧化产物; 是还原产物.
(2)在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,
考点:氧化还原反应,物质的量的相关计算
专题:化学用语专题,氧化还原反应专题
分析:(1)依据乙醇分子式计算相对分子质量,相对分子质量数值上等于摩尔质量,依据n=
,c=
=
计算;
(2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,以此来解答.
| m |
| M |
| n |
| V |
| N |
| NA |
(2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,以此来解答.
解答:
解:(1)乙醇(俗名酒精)分子式为C2H6O,其相对分子质量为46,摩尔质量为46g/mol,92g乙醇的物质的量=
=2mol,配制成500mL溶液,其物质的量浓度=
=4mol/L,从中取出5mL该溶液,溶质物质的量=0.005L×4mol/L=0.02mol,约取出了乙醇分子数=0.02mol×NA=0.02NA;
故答案为:46;46g/mol;2mol;4mol?L-1;0.02NA;
(2)在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素化合价由0价升高到+2价,被氧化,Cu为还原剂,N元素化合价由+5价降低到+2价,被还原,HNO3为氧化剂,Cu(NO3)2为氧化产物,NO为还原产物.
故答案为:HNO3;Cu;Cu;N;Cu(NO3)2;NO.
| 92g |
| 46g/mol |
| 2mol |
| 0.5L |
故答案为:46;46g/mol;2mol;4mol?L-1;0.02NA;
(2)在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素化合价由0价升高到+2价,被氧化,Cu为还原剂,N元素化合价由+5价降低到+2价,被还原,HNO3为氧化剂,Cu(NO3)2为氧化产物,NO为还原产物.
故答案为:HNO3;Cu;Cu;N;Cu(NO3)2;NO.
点评:本题考查较为综合,涉及物质的量的计算以及氧化还原反应,为高考常见题型,侧重氧化还原反应中基本概念的考查,明确含元素化合价降低的物质为氧化剂、还原剂被氧化等即可解答,题目较简单.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、二氧化碳的水溶液能导电,所以二氧化碳是电解质 |
| B、1mol?L-1的硫酸钠溶液和1mol?L-1的氢氧化钠溶液,分别做导电性实验,两种溶液的导电性不同 |
| C、氢氧化铁胶体能导电,故氢氧化铁胶体是电解质 |
| D、在相同温度下,饱和溶液一定比不饱和溶液的导电性强 |
在下列反应中,水既不作氧化剂又不作还原剂的氧化还原反应是( )
| A、2Na+2H2O═2NaOH+H2↑ | ||||
B、C+H2O(g)
| ||||
| C、CaO+H2O═Ca(OH)2 | ||||
| D、Cl2+H2O═HCl+HClO |
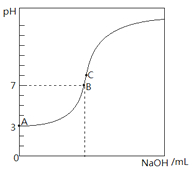 常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )
常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )| A、由图可知HA是一种弱酸,且Ka=1.0×10-5 |
| B、滴定到B点时,c(Na+)=c(A-) |
| C、当NaOH溶液的体积为10.00mL时,有c(A-)+c(OH-)=c(H+)+c(HA) |
| D、C点溶液中的离子浓度关系为:c(Na+)>c(A-) |
 )互为同系物.
)互为同系物.

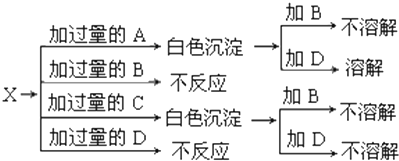 如图中A、B、C、D分别是KNO3、KOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.
如图中A、B、C、D分别是KNO3、KOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.