题目内容
9.在25℃、101kPa的条件下,同质量的CH4和A气体的体积之比是15:8,则A的摩尔质量为30g/mol.分析 根据同温同压下体积之比等于物质的量之比计算,结合n=$\frac{m}{M}$计算.
解答 解:在T、P相同时,体积之比等于物质的量之比,即15:8=$\frac{mg}{16g/mol}$:$\frac{mg}{M(A)}$,解得M(A)=30g/mol,
故答案为:30g/mol.
点评 本题考查了摩尔质量的简单计算,题目难度不大,要求学生熟练掌握物质的量、摩尔质量、气体摩尔体积间的转化关系.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目
20.下列说法中不正确的是( )
| A. | Na2O2可用作呼吸面具中氧气的来源 | |
| B. | Na2O 和Na2O2投入水中都能生成NaOH | |
| C. | Na2O2和Na2O 均可以露置在空气中保存 | |
| D. | NaCl的性质稳定,可用作调味品 |
17.下列实验操作的描述中,正确的是( )
| A. | 取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 用溶解、过滤的方法分离氯化钠和硝酸钾的混合物 | |
| C. | 称量NaOH固体,先在天平两盘上放大小相等纸片,然后NaOH放在左盘纸片上称量 | |
| D. | 利用丁达尔效应可以区别溶液和胶体 |
4.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 17gOH-中含有的电子数为10NA | |
| B. | 标准状况下,lmol CCl4的体积约为22.4L | |
| C. | 1mol/LNa2CO3溶液中含有的Na+离子数为2NA | |
| D. | 常温常压下,1NA个CO2分子占有的体积为22.4L |
14.下列说法正确的是( )
| A. | 锌锰电池和碱性锌锰电池的正极材料均是锌 | |
| B. | 锌锰电池中电解质主要是NH4Cl,而碱性锌锰电池中的电解质主要是KOH | |
| C. | 碱性锌锰电池不如锌锰电池的寿命长 | |
| D. | 干电池放电之后还可再充电 |
7.一定温度下,反应O2(g)+2H2(g)?2H2O(g)的反应热和化学平衡常数分别为△H和K,则相同温度下反应4H2O(g)?2O2(g)+4H2(g)的反应热和化学平衡常数为( )
| A. | 2△H和2K | B. | -2△H和K2 | C. | 2△H和-2K | D. | -2△H和K-2 |
4.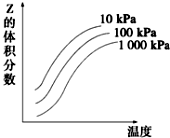 图是温度和压强对X+Y?2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡时混合气体中Z的体积分数.下列叙述正确的是( )
图是温度和压强对X+Y?2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡时混合气体中Z的体积分数.下列叙述正确的是( )
 图是温度和压强对X+Y?2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡时混合气体中Z的体积分数.下列叙述正确的是( )
图是温度和压强对X+Y?2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡时混合气体中Z的体积分数.下列叙述正确的是( )| A. | 上述可逆反应的正反应为放热反应 | B. | X、Y、Z均为气态 | ||
| C. | 增大压强平衡向正反应方向移动 | D. | 上述反应的逆反应的△H<0 |
5.下列说法正确的是( )
| A. | 煤、石油是不可再生能源,天然气是可再生能源 | |
| B. | 在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 | |
| C. | 热值指在一定条件下,1mol的物质完全燃烧所放出的热量 | |
| D. | 若化学过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热 |