题目内容
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.某学生为测定未知浓度的硫酸溶液,实验如下:以0.14mol?L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
(1)该学生用标准0.14mol?L-1NaOH溶液滴定硫酸的实验操作如下:
A、检查滴定管是否漏水
B、用蒸馏水洗干净滴定管
C、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
D、用待测定的溶液润洗酸式滴定管
E、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂.
F、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G、另取锥形瓶,再重复操作一次
①该滴定操作中应选用的指示剂是
②在F操作中如何确定终点?
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值
考点:中和滴定
专题:实验题
分析:(1)①根据氢氧化钠与硫酸恰好中和溶液的pH为7选择使用的指示剂;②根据滴定结束前硫酸溶液的颜色及反应结束后混合液的颜色变化判断滴定终点;
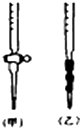
(2)甲为酸式滴定管,乙为碱式滴定管;
(3)滴定管没有润洗,滴定管内的蒸馏水导致盛装的溶液体积增大,溶液浓度减小;
(4)根据c(待测)=
分析不当操作对V(标准)的影响,以此判断浓度的误差;
(2)甲为酸式滴定管,乙为碱式滴定管;
(3)滴定管没有润洗,滴定管内的蒸馏水导致盛装的溶液体积增大,溶液浓度减小;
(4)根据c(待测)=
| c(标注)×V(标准) |
| V(待测) |
解答:
解:(1)①由于氢氧化钠与硫酸恰好中和,溶液的pH=7,可以选用酚酞(变色范围为:8-10)作为指示剂,
故答案为:酚酞;
②滴定结束前,滴入酚酞的硫酸溶液为无色,滴定结束时,溶液变成红色,所以滴定终点现象为:滴入最后一滴NaOH溶液,溶液突然变成红色,半分钟不褪色,
故答案为:滴入最后一滴NaOH溶液,溶液突然变成红色,半分钟不褪色;
(2)甲特点为玻璃活塞,为酸式滴定管,甲特点橡胶管、玻璃珠,为碱式滴定管,所以用标准NaOH溶液滴定时,应将标准NaOH溶液注入乙,
故答案为:乙;
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗,相当于标准液被稀释,所以消耗掉的稀硫酸就会增多,滴定结果偏大,
故答案为:偏大;
(4)从滴定管读数时,滴定前仰视,滴定后俯视,造成V(标准)偏小,根据c(待测)=
可知,测定c(待测)偏小,
故选:偏小;
故答案为:酚酞;
②滴定结束前,滴入酚酞的硫酸溶液为无色,滴定结束时,溶液变成红色,所以滴定终点现象为:滴入最后一滴NaOH溶液,溶液突然变成红色,半分钟不褪色,
故答案为:滴入最后一滴NaOH溶液,溶液突然变成红色,半分钟不褪色;
(2)甲特点为玻璃活塞,为酸式滴定管,甲特点橡胶管、玻璃珠,为碱式滴定管,所以用标准NaOH溶液滴定时,应将标准NaOH溶液注入乙,
故答案为:乙;
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗,相当于标准液被稀释,所以消耗掉的稀硫酸就会增多,滴定结果偏大,
故答案为:偏大;
(4)从滴定管读数时,滴定前仰视,滴定后俯视,造成V(标准)偏小,根据c(待测)=
| c(标注)×V(标准) |
| V(待测) |
故选:偏小;
点评:本题考查了酸碱中和滴定实验操作及误差分析,题目难度中等,要求学生熟记酸碱中和滴定的实验步骤和注意事项,就能顺利完成此类题目,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生规范的实验设计能力.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列实验操作,正确的是( )
| A、中和滴定时,用标准液润洗滴定管,用待测液润洗锥形瓶,并滴入l mL指示剂 |
| B、配制物质的量浓度溶液时,将称量好的溶质溶于盛有适量水的烧杯中,溶解后立即倾入容量瓶中,继续进行洗涤和定容 |
| C、制取Fe(OH)2时,吸取NaOH溶液的胶头滴管的末端应插入FeSO4溶液中,再缓缓将NaOH溶液挤出 |
| D、溴乙烷和烧碱溶液共热后,将硝酸银溶液滴入水解液中,即可见到淡黄色沉淀 |
如图图示与对应叙述相符合的是( )
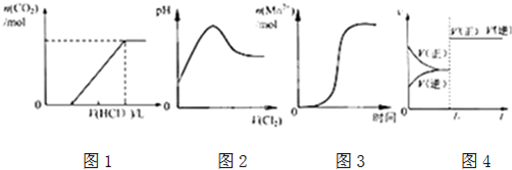

| A、图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol?L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
| B、图2表示Cl2通入H2S溶液中pH的变化 |
| C、图3表示10 mL 0.01 mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) |
| D、图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
 生成铝的产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.请回答下列问题:
生成铝的产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.请回答下列问题: