题目内容
实验是化学研究的基础.
(1)工业上常用电解熔融NaCl的方法制取金属钠,NaCl熔化时破坏离子键的过程属于 (填“物理变化”或“化学变化”).
(2)实验室中,加热熔融NaOH时,选用铁坩埚而不使用瓷坩埚,其原因为 (用化学方程式解释)
(3)关于下列各装置图的叙述正确的是 (填序号)
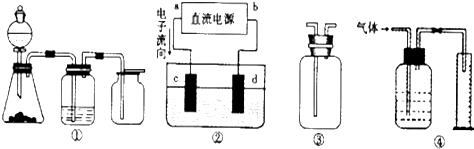
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2,、HCl、NO2等
D.装置④能用于测量气体体积
(4)冶炼铜的反应为8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2上述冶炼过程产生大量SO2.下列处理SO2的方案中合理的是 (填代号).
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收.
(1)工业上常用电解熔融NaCl的方法制取金属钠,NaCl熔化时破坏离子键的过程属于
(2)实验室中,加热熔融NaOH时,选用铁坩埚而不使用瓷坩埚,其原因为
(3)关于下列各装置图的叙述正确的是

A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2,、HCl、NO2等
D.装置④能用于测量气体体积
(4)冶炼铜的反应为8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2上述冶炼过程产生大量SO2.下列处理SO2的方案中合理的是
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收.
考点:实验装置综合,物理变化与化学变化的区别与联系,二氧化硫的化学性质,硅和二氧化硅
专题:
分析:(1)NaCl熔化的过程为物理过程,没有新物质生成;
(2)瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀;
(3)A、铜屑与稀硝酸反应需要加热;
B、与直流电源正极相连的极为阳极,电子流向与电流流向相反;
C、此装置用于排空气法收集气体;
D、测量气体体积集气瓶中应装满水;
(4)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收.
(2)瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀;
(3)A、铜屑与稀硝酸反应需要加热;
B、与直流电源正极相连的极为阳极,电子流向与电流流向相反;
C、此装置用于排空气法收集气体;
D、测量气体体积集气瓶中应装满水;
(4)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收.
解答:
解:(1)NaCl熔化的过程为物理过程,没有新物质生成,只存在离子键的断裂,没有生成新的化学键,属于物理变化,故答案为:物理变化;
(2)瓷坩埚中的二氧化硅和强碱反应,酸性氧化物与碱反应生成盐和水,二氧化硅与氢氧化钠反应生成硅酸钠和水,其反应的化学方程式为SiO2+2NaOH═Na2SiO3+H2O,
故答案为:SiO2+2NaOH=Na2SiO3+H2O;
(3)A、铜屑与稀硝酸反应需要加热,此反应不能加热,故错误;
B、与直流电源正极相连的极为阳极,电子流向与电流流向相反,b为正极,故错误;
C、此装置用于排空气法收集气体,故正确;
D、测量气体体积集气瓶中应装满水,故错误,
故选C;
(4)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收,与浓硫酸不反应,也不能直接排放,故答案为:bc.
(2)瓷坩埚中的二氧化硅和强碱反应,酸性氧化物与碱反应生成盐和水,二氧化硅与氢氧化钠反应生成硅酸钠和水,其反应的化学方程式为SiO2+2NaOH═Na2SiO3+H2O,
故答案为:SiO2+2NaOH=Na2SiO3+H2O;
(3)A、铜屑与稀硝酸反应需要加热,此反应不能加热,故错误;
B、与直流电源正极相连的极为阳极,电子流向与电流流向相反,b为正极,故错误;
C、此装置用于排空气法收集气体,故正确;
D、测量气体体积集气瓶中应装满水,故错误,
故选C;
(4)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收,与浓硫酸不反应,也不能直接排放,故答案为:bc.
点评:本题考查物理变化与化学变化的本质、电解池原理、污染气体处理等,题目难度不大.

练习册系列答案
相关题目
常温下,把0.1mol?L-1HA溶液(已知其pH=3)和0.05mol?L-1NaOH溶液等体积混合,混合溶液的pH=5,则下列表示混合溶液中粒子浓度关系不正确的是( )
| A、c(A-)>c(Na+) |
| B、c(HA)<c(A-) |
| C、c(Na+)>c(OH-) |
| D、c(HA)+c(A-)=0.1 mol/L |
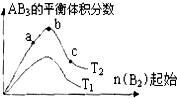 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是( )| A、达到平衡时A2的转化率大小为:c>b>a |
| B、a、b、c三点的平衡常数相同 |
| C、该反应一定是放热反应,且T2<T1 |
| D、b点时,平衡体系中A、B原子数之比一定是1:1 |
下列叙述中,不正确的是( )
| A、常温下,pH=3的盐酸与pH=11的氨水溶液中水的电离程度相同 |
| B、滴定相同体积和物质的量浓度的盐酸和醋酸,消耗一定物质的量浓度的烧碱溶液的体积相同 |
| C、0.1 mol/L的Na2CO3溶液和0.01 mol/LNaHCO3溶液中离子种类相同,而且都满足关系式:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) |
| D、常温下,pH值之和为14的醋酸和NaOH溶液,等体积混合后,溶液pH>7 |

 、
、 、
、 、
、 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.