题目内容
6.下列各组离子在溶液中可以大量共存的是( )| A. | H+、SO32-、S2-、K+ | B. | Fe3+、Cl-、S2-、Ba2+ | ||
| C. | Cu2+、Cl-、S2-、K+ | D. | Na+、K+、S2-、SO42- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应,则离子大量共存,以此来解答.
解答 解:A.H+、SO32-、S2-三者发生氧化还原反应生成单质S沉淀,不能共存,故A错误;
B.Fe3+能氧化S2-不能大量共存,不能共存,故B错误;
C.Cu2+和S2-反应生成CuS沉淀,不能大量共存,故C错误;
D.该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.侧重对学生基础知识的训练和检验.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.足量的氯气或盐酸分别跟下列金属反应,均有MCl2型化合物生成的是( )
| A. | Al | B. | Mg | C. | Fe | D. | Na |
14.草酸(H2C2O4)是一种重要的化工原料,常温下其K1=5.4×10-2、K2=5.4×10-5.常温下几种草酸盐溶液的pH见下表:
下列溶液中离子的物质的量浓度关系正确的是( )
| 编号 | ① | ② | ③ |
| 溶液 | 0.01mol/L KHC2O4 | 0.01mol/L K2C2O4 | 溶液①与溶液②等体积混合 |
| pH | 3.1 | 8.1 | 未测定 |
| A. | ①中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| B. | ②中:c(K+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) | |
| C. | ③中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) | |
| D. | ③中:2c(OH-)+c(C2O42-)=3c(H2C2O4)+c(HC2O4-)+2c(H+) |
11.用NA表示阿伏加德罗常数的值,下列判断正确的是( )
| A. | 11.1 mol•L-1KCIO3溶液中含有的氯离子数目为NA | |
| B. | 标准状况下,22.4L H2O含有的分子数目为NA | |
| C. | 16g O2与16gO3含有的氧原子数目相等 | |
| D. | 1 mol Zn变为Zn2+时失去的电子数目为NA |
15.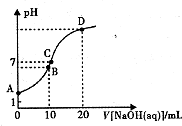 常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )
常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )
 常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )
常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )| A. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}A)}$增大 | |
| B. | B点:c( HA -)>c(H+)>c(A2一)>c(H2A) | |
| C. | C点:c(Na+)=c(HA-)+2c( A2-) | |
| D. | 水电离出来的c(OH-):B点>D点 |
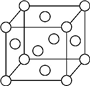 A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题: